题目内容
在一定温度下,向容积固定的密闭容器中充入amolC(g),发生如下可逆反应:2A(g)+B(g) 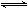 2C(g) △H <0。达平衡后再向容器中充入 amolC(g),再达平衡后,与原平衡比较,下列叙述正确的是
2C(g) △H <0。达平衡后再向容器中充入 amolC(g),再达平衡后,与原平衡比较,下列叙述正确的是
A. 平均相对分子质量减小 B. C的转化率增大
C. C的质量分数增大 D. 反应热大于原来的2倍
【答案】
C
【解析】
试题分析:根据反应2C(g)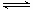 2A(g)+B(g)可知,C生成A和B的反应是体积增大的可逆反应。由于反应物只有C,因此在原平衡的基础上再充入amolC,则相当于是增大压强,平衡向逆反应方向移动,即C的转化率降低,而C的质量分数增大,B不正确,C正确;C的转化率降低,消耗C的物质的量小于原来的2倍,所以反应热小于原来2倍,D不正确;气体质量不变,物质的量减小,所以混合气的平均相对分子质量增大,A不正确,答案选C。
2A(g)+B(g)可知,C生成A和B的反应是体积增大的可逆反应。由于反应物只有C,因此在原平衡的基础上再充入amolC,则相当于是增大压强,平衡向逆反应方向移动,即C的转化率降低,而C的质量分数增大,B不正确,C正确;C的转化率降低,消耗C的物质的量小于原来的2倍,所以反应热小于原来2倍,D不正确;气体质量不变,物质的量减小,所以混合气的平均相对分子质量增大,A不正确,答案选C。
考点:考查外界条件对平衡状态的影响以及可逆反应与反应热的有关计算等

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
在一定温度下,向容积为2L的密闭容器中充入一定量的CO和NO2发生反应:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0.有关该反应的描述正确的是( )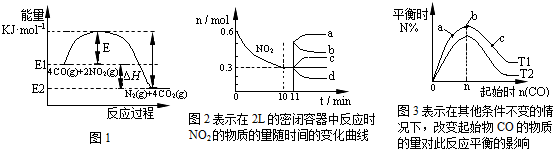

| A、在一定温度、固定容积的密闭容器里,混合气体的密度不再改变可以说明上述可逆反应已达平衡 | B、由图1可得加入适当的催化剂,E和△H都减小 | C、图2中0~10min内该反应的平均速率v(CO)=0.03mol?L-1?min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(NO2)的变化曲线为d | D、图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |