题目内容
在一定温度下,向容积固定不变的密闭容器中充入a mol PCl5,发生如下反应:PCl5(g)?PCl3(g)+Cl2(g);达平衡后再向容器中充入amol PCl5,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
分析:容积固定,达平衡后再向容器中充入amol PCl5,相当于增大了压强;
A、容器容积不变,加入了五氯化磷,气体质量增加,密度增大;
B、由于增大了压强,平衡向左移动,混合气体的物质的量减少;
C、压强增大,平衡向左移动,PCl5的转化率降低;
D、PCl5的转化率降低,含量增加了,质量分数增大.
A、容器容积不变,加入了五氯化磷,气体质量增加,密度增大;
B、由于增大了压强,平衡向左移动,混合气体的物质的量减少;
C、压强增大,平衡向左移动,PCl5的转化率降低;
D、PCl5的转化率降低,含量增加了,质量分数增大.
解答:解:相当于将两个相同条件下得到平衡状态的且容积不变的容器合并为一个容器,混合气体的压强增大,平衡会向左移动;
A、反应前后都是气体,五氯化磷增加,容积不变,气体质量增加,密度自然增大,故A正确;
B、由于化学平衡向左移动,物质的量减少,气体相对平均分子质量增大,故B正确;
C、化学平衡向左移动,五氯化磷的转化率降低,故C错误;
D、五氯化磷的转化率降低,含量增大,故D正确;
故选C.
A、反应前后都是气体,五氯化磷增加,容积不变,气体质量增加,密度自然增大,故A正确;
B、由于化学平衡向左移动,物质的量减少,气体相对平均分子质量增大,故B正确;
C、化学平衡向左移动,五氯化磷的转化率降低,故C错误;
D、五氯化磷的转化率降低,含量增大,故D正确;
故选C.
点评:本题考查压强对化学平衡的影响,注意容器容积不变,气体质量增大,密度增大,本题难度中等.

练习册系列答案
相关题目
在一定温度下,向容积为2L的密闭容器中充入一定量的CO和NO2发生反应:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0.有关该反应的描述正确的是( )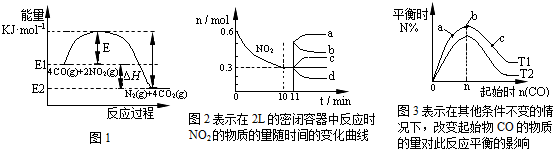

| A、在一定温度、固定容积的密闭容器里,混合气体的密度不再改变可以说明上述可逆反应已达平衡 | B、由图1可得加入适当的催化剂,E和△H都减小 | C、图2中0~10min内该反应的平均速率v(CO)=0.03mol?L-1?min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(NO2)的变化曲线为d | D、图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |