题目内容
Ⅰ.在容积为2.0L,的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图1,据图同答下列问题:
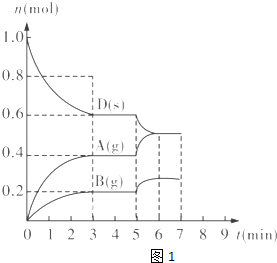
(l)从反应开始到第一次达到平衡时,A物质的平均反应速率为 .
(2)根据图1写出该反应的化学方程式 ,该反应的平衡常数K= .
(3)第5min时,升高温度,A、B、D的物质的量变化如图1,则降温,该反应的平衡常数 (填“增大”、“减小”或“不变”).
Ⅱ.可逆反应:①X(g)+2Y(g)?2Z(g)②2M(g)?N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板.反应开始和达到平衡状态时有关物理量的变化如图2所示:

请同答下列问题:
(1)达平衡(I)时,X的转化率为 .
(2)X(g)+2Y(g)?2Z(g)是 (填“吸”或“放”)热反应.

(l)从反应开始到第一次达到平衡时,A物质的平均反应速率为
(2)根据图1写出该反应的化学方程式
(3)第5min时,升高温度,A、B、D的物质的量变化如图1,则降温,该反应的平衡常数
Ⅱ.可逆反应:①X(g)+2Y(g)?2Z(g)②2M(g)?N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板.反应开始和达到平衡状态时有关物理量的变化如图2所示:

请同答下列问题:
(1)达平衡(I)时,X的转化率为
(2)X(g)+2Y(g)?2Z(g)是
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素
专题:化学平衡专题
分析:Ⅰ、(1)根据V=
进行计算;
(2)根据各物质的增减判断反应物、生成物,根据同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比判断;化学平衡常数等于平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
(3)根据温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动;根据平衡常数只有与温度有关;
Ⅱ、(1)相同压强下,根据物质的量之比等于体积之比计算①中气体的物质的量,进而求出转化率;
(2)从降温导致平衡(Ⅰ)向平衡(Ⅱ)移动时,X、Y、Z的总物质的量变化导致反应移动的方向来判断反应是吸热还是放热.
| △c |
| △t |
(2)根据各物质的增减判断反应物、生成物,根据同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比判断;化学平衡常数等于平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
(3)根据温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动;根据平衡常数只有与温度有关;
Ⅱ、(1)相同压强下,根据物质的量之比等于体积之比计算①中气体的物质的量,进而求出转化率;
(2)从降温导致平衡(Ⅰ)向平衡(Ⅱ)移动时,X、Y、Z的总物质的量变化导致反应移动的方向来判断反应是吸热还是放热.
解答:
解:Ⅰ、(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为
=
=0.067mol/L?min;
故答案为:0.067mol/L?min;
(2)根据图象知,随着反应的进行,D的物质的量减少,A、B的物质的量增加,所以D是反应物,A、B是生成物;同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比,0-3min时,△D=0.4mol,
△A=0.4mol,△B=0.2mol,△D:△A:△B=0.4mol:0.4mol:0.2mol=4:4:2,方程式为:2D(s)?2A(g)+B(g); 因D为固体,所以化学平衡常数K=C2(A)×C(B)=(
)2×
=0.004(mol/L)2;
故答案为:2D(s)?2A(g)+B(g),0.004(mol/L)2;
(3)温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动,说明正反应为吸热反应,
平衡常数只有与温度有关,温度升高,平衡正向移动,平衡常数增大,降温平衡逆向进行,平衡常数减小;
故答案为:减小;
Ⅱ、(1)、达平衡(Ⅰ)时,右边气体的物质的量不变,仍为2mol,左右气体压强相等,设平衡时左边气体的物质的量为xmol,
则有:
=
,x=
=
mol,即物质的量减少了3-
=
mol,反应特征分析减少量是反应的X的量,所以达平衡(Ⅰ)时,X的转化率为
×100%=83.3%;
故答案为:83.3%;
(2)降温由平衡(Ⅰ)向平衡(Ⅱ)移动,同时X、Y、Z的总物质的量增大,说明平衡向左移动,正反应为吸热反应;
故答案为:吸.
| △c |
| △t |
| ||
| 3min |
故答案为:0.067mol/L?min;
(2)根据图象知,随着反应的进行,D的物质的量减少,A、B的物质的量增加,所以D是反应物,A、B是生成物;同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比,0-3min时,△D=0.4mol,
△A=0.4mol,△B=0.2mol,△D:△A:△B=0.4mol:0.4mol:0.2mol=4:4:2,方程式为:2D(s)?2A(g)+B(g); 因D为固体,所以化学平衡常数K=C2(A)×C(B)=(
| 0.4mol |
| 2.0L |
| 0.2mol |
| 2.0L |
故答案为:2D(s)?2A(g)+B(g),0.004(mol/L)2;
(3)温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动,说明正反应为吸热反应,
平衡常数只有与温度有关,温度升高,平衡正向移动,平衡常数增大,降温平衡逆向进行,平衡常数减小;
故答案为:减小;
Ⅱ、(1)、达平衡(Ⅰ)时,右边气体的物质的量不变,仍为2mol,左右气体压强相等,设平衡时左边气体的物质的量为xmol,
则有:
| 2 |
| x |
| 2.4 |
| 2.6 |
| 2×2.6 |
| 2.4 |
| 13 |
| 6 |
| 13 |
| 6 |
| 5 |
| 6 |
| ||
| 1mol |
故答案为:83.3%;
(2)降温由平衡(Ⅰ)向平衡(Ⅱ)移动,同时X、Y、Z的总物质的量增大,说明平衡向左移动,正反应为吸热反应;
故答案为:吸.
点评:本题考查图象分析应用,反应速率概念计算,平衡常数影响因素分析判断,化学平衡移动问题,具有一定难度,做题注意从右边反应体系中的物质的量不变考虑,题目难度较大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、将2mol NO和1mol O2混合后,体系中的原子总数大于6NA |
| B、0.01mol Mg在CO2中完全燃烧,转移电子数为0.02NA |
| C、标准状况下,3.2g Cu与足量的浓硝酸反应生成气体的分子数为0.2NA |
| D、7.8g Na2O2含有的阴离子数为0.2NA |
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: