题目内容
常温下,一定量的醋酸与氢氧化钠发生中和反应,当溶液中( )
| A.c(CH3COO-)=c(Na+)时,该溶液一定呈中性 |
| B.c(CH3COO-)=c(Na+)时,醋酸和氢氧化钠恰好完全中和 |
| C.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,可能是醋酸过量 |
| D.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是NaOH过量 |
A
解析试题分析:根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),当c(CH3COO-)=c(Na+)时必有c(H+)=c(OH-),溶液呈中性,醋酸有剩余,当c(CH3COO-)>c(Na+)时,必有c(CH+)<c(OH-),故B、C错误,A正确;D选项,当醋酸和NaOH恰好中和时,溶质为CH3COONa,也满足题意,所以答案选A。
考点:考查中和滴定实验中离子浓度大小比较的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。
该题的关键是利用好几种守恒关系,即电荷守恒、物料守恒和质子守恒,并能灵活运用即可。

练习册系列答案
相关题目
常温下,一定量的醋酸中逐滴滴加氢氧化钠溶液发生中和反应.下列说法不正确的是( )
| A、在任何情况下都存在c(CH3COO-)+c(OH-)=c(Na+)+c(H+) | B、当溶液中c(CH3COO-)>c(Na+)时.溶液可能显中性 | C、当溶液中c(CH3COO-)=c(Na+)>c(H+)=c(OH-)时,一定是醋酸过量 | D、当溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,可能是醋酸过量 |
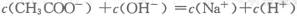
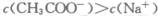 时,溶液可能显中性
时,溶液可能显中性