题目内容
常温下,一定量的醋酸与氢氧化钠溶液发生中和反应,下列说法正确的是( )
分析:A.根据溶液的电荷守恒分析;
B.醋酸与氢氧化钠恰好完全中和,溶液呈碱性;
C.c(H+)>c(OH-),溶液呈酸性,醋酸过量;
D.醋酸与氢氧化钠恰好完全中和,存在c(Na+)>c(CH3COO0-)>c(OH-)>c(H+).
B.醋酸与氢氧化钠恰好完全中和,溶液呈碱性;
C.c(H+)>c(OH-),溶液呈酸性,醋酸过量;
D.醋酸与氢氧化钠恰好完全中和,存在c(Na+)>c(CH3COO0-)>c(OH-)>c(H+).
解答:解:A.根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可知,当c(CH3COO─)=c(Na+)时,c(OH-)=c(H+),即溶液显中性,故A正确;
B.若醋酸和氢氧化钠恰好反应,由于生成物醋酸钠水解,溶液呈碱性,应为c(Na+)>c(CH3COO0-),当c(CH3COO─)=c(Na+)时,溶液呈中性,故B错误;
C.由于醋酸为弱酸,当c(H+)>c(OH-),溶液呈酸性,醋酸过量,故C错误;
D.如醋酸和氢氧化钠恰好中和,也满足c(Na+)>c(CH3COO0-)>c(OH-)>c(H+),故D错误.
故选A.
B.若醋酸和氢氧化钠恰好反应,由于生成物醋酸钠水解,溶液呈碱性,应为c(Na+)>c(CH3COO0-),当c(CH3COO─)=c(Na+)时,溶液呈中性,故B错误;
C.由于醋酸为弱酸,当c(H+)>c(OH-),溶液呈酸性,醋酸过量,故C错误;
D.如醋酸和氢氧化钠恰好中和,也满足c(Na+)>c(CH3COO0-)>c(OH-)>c(H+),故D错误.
故选A.
点评:本题考查酸碱混合的定性判断,题目难度不大,注意醋酸为弱电解质的特点,结合溶液的电荷守恒解答该题.

练习册系列答案
相关题目
常温下,一定量的醋酸中逐滴滴加氢氧化钠溶液发生中和反应.下列说法不正确的是( )
| A、在任何情况下都存在c(CH3COO-)+c(OH-)=c(Na+)+c(H+) | B、当溶液中c(CH3COO-)>c(Na+)时.溶液可能显中性 | C、当溶液中c(CH3COO-)=c(Na+)>c(H+)=c(OH-)时,一定是醋酸过量 | D、当溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,可能是醋酸过量 |
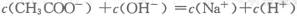
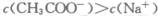 时,溶液可能显中性
时,溶液可能显中性