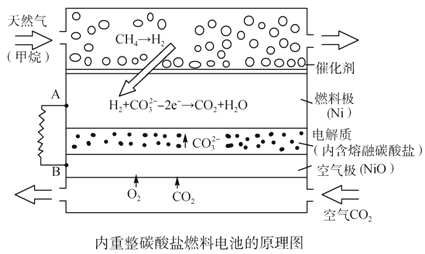
题目内容
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeCO3F)为原料制备CeO2的一种工艺流程如下:

已知:i.Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSOa4]2+;
ii.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能
iii.常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol/L。请回答下列问题:
(1)铈的原子序数是58,它在元素周期表的位置是_________________________。
(2)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是____________________、_________________(写出2种即可)。
(3)“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式为________________。浸出的过程中常加入适量的Na2SO4浓溶液,其作用是_____________________________。
(4)“萃取”时存在反应:Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+。萃取后水层中还存在的含铈元素的微粒主要是__________,经处理后可循环使用。
Ce(H2n-4A2n)+4H+。萃取后水层中还存在的含铈元素的微粒主要是__________,经处理后可循环使用。
(5)“反萃取”中加H2O2的主要反应离子方程式为_______________________。在“反萃取”后所得水层中加入1.0mol/L的NH4HCO3溶液,产生Ce2(CO3)3沉淀,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol/L],溶液中c(CO32-)约为______________。
(6)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。请写出CeO2消除CO尾气的化学方程式_____________________________。
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。请写出CeO2消除CO尾气的化学方程式_____________________________。
【答案】 第六周期 III B族 矿石粉碎成细小颗粒 通入大量空气 CeO2+4H++SO42-![]() [CeSO4]2++H2O 增大c(SO42-),以提高[CeSO4]2+的浸出率 [CeSO4]2+、Ce4+ 2Ce4++H2O2=2Ce3++O2↑+2H+ 1×10-6mol/L 2xCO+CeO2=CeO2(1-x)+2xCO2
[CeSO4]2++H2O 增大c(SO42-),以提高[CeSO4]2+的浸出率 [CeSO4]2+、Ce4+ 2Ce4++H2O2=2Ce3++O2↑+2H+ 1×10-6mol/L 2xCO+CeO2=CeO2(1-x)+2xCO2
【解析】(1)根据稀有气体氙的原子序数为54,位于第5周期0族,因此下推一个周期,即第6周期,第IA族,IIA族,原子序数分别为55、56,接下来为镧系,57-71之间,位于第六周期、III B族;所以铈的原子序数是58,位于第六周期、III B族;正确答案:第六周期、III B族。
(2)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是矿石粉碎成细小颗粒、通入大量空气等;正确答案:矿石粉碎成细小颗粒、通入大量空气。
(3)由题意Ce4+能与SO42-结合成[CeSO4]2+,则“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式为CeO2+4H++SO42-![]() [CeSO4]2++H2O;正确答案:CeO2+4H++SO42-
[CeSO4]2++H2O;正确答案:CeO2+4H++SO42-![]() [CeSO4]2++H2O 。随着溶液中c(SO42-)增大,水层中Ce4+与SO42-结合成[CeSO4]2+,导致萃取平衡向生成[CeSO4]2+方向移动,以提高[CeSO4]2+的浸出率;正确答案:CeO2+4H++SO42-
[CeSO4]2++H2O 。随着溶液中c(SO42-)增大,水层中Ce4+与SO42-结合成[CeSO4]2+,导致萃取平衡向生成[CeSO4]2+方向移动,以提高[CeSO4]2+的浸出率;正确答案:CeO2+4H++SO42-![]() [CeSO4]2++H2O;增大c(SO42-),以提高[CeSO4]2+的浸出率。
[CeSO4]2++H2O;增大c(SO42-),以提高[CeSO4]2+的浸出率。
(4)“萃取”时存在反应:Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+,该反应为可逆反应,萃取后水层中还存在的含铈元素的微粒主要是[CeSO4]2+、Ce4+,经处理后可循环使用;正确答案:[CeSO4]2+、Ce4+。
Ce(H2n-4A2n)+4H+,该反应为可逆反应,萃取后水层中还存在的含铈元素的微粒主要是[CeSO4]2+、Ce4+,经处理后可循环使用;正确答案:[CeSO4]2+、Ce4+。
(5)根据流程图,“反萃取”中加H2O2后Ce4+转化为Ce3+,说明H2O2作还原剂,被Ce4+氧化生成氧气,反应的离子方程式为:2Ce4++H2O2=2Ce3++O2↑+2H+ ;由题意可知,常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol·L-1,则Ksp[Ce2(CO3)3]=(2![]() 10-6)2
10-6)2![]() (3
(3![]() 10-6)3=1.08
10-6)3=1.08![]() 10-28,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol·L-1],溶液中c(CO32-)为
10-28,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol·L-1],溶液中c(CO32-)为![]() 1
1![]() 10-6mol/L;正确答案:2Ce4++H2O2=2Ce3++O2↑+2H+ ;1×10-6mol/L。
10-6mol/L;正确答案:2Ce4++H2O2=2Ce3++O2↑+2H+ ;1×10-6mol/L。
(6)CeO2消除CO尾气的过程中,CO是还原剂被CeO2氧化为CO2,CeO2作氧化剂,被CO还原为CeO2(1-x),反应的化学方程式为:2xCO+CeO2=CeO2(1-x)+2xCO2;正确答案:2xCO+CeO2=CeO2(1-x)+2xCO2。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】(1)某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1 mol·L1 FeCl3溶液、0.1 mol·L1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
①用所给试剂写出体现Fe2+具有还原性的反应的化学方程式:_________________________________。
②设计实验方案,完成下列表格。
探究内容 | 实验方案 | 实验现象 |
探究Fe3+具有氧化性 | 取少量0.1 mol·L1 FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 | 加入铁粉后,溶液颜色变为________。加入KSCN溶液后,溶液________ |
③该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为_________________________________________。
(2)某反应中反应物与生成物有Fe3+、Mn2+、H+、![]() 、H2O和一种未知离子X,已知
、H2O和一种未知离子X,已知![]() 在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
(3)有一铁的氧化物样品,用5 mol·L1的盐酸140 mL恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为________。
【题目】铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜版腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式____________________________________。
(2)若将(1)中的反应设计成如图所示原电池,则负极反应式为:_____________________,正极反应式:________________________;电子从_______流向________(填“Cu”或“石墨”)。

(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,完成除去CuCl2溶液中Fe3+和Fe2+的实验步骤。
①通入足量_________将Fe2+氧化为Fe3+。
②加入_________调节溶液的pH至3.2~4.7,使______________ 完全沉淀然后过滤。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||