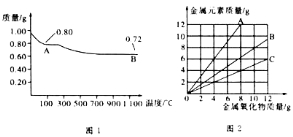
题目内容
【题目】在某个容积为2 L的密闭容器内,在T℃时按下图1所示发生反应:
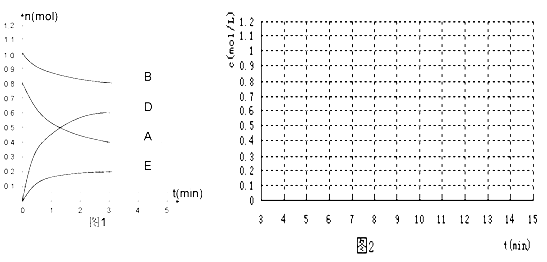
mA(g)+nB(g)![]() pD(g)+qE(s) H<0(m、n、p、q为最简比例的整数)。
pD(g)+qE(s) H<0(m、n、p、q为最简比例的整数)。
(1)根据图1所示,反应开始至达到平衡时,用D表示该反应速率为____________ mol/(L·min);方程式中m:n:p:q =________________
(2)该反应的化学平衡常数K为_________________(保留至一位小数);
(3)下列措施能增大B的转化率的是 ( )
A.升高温度 B.保持体积不变通入1molB
C.保持体积不变移出部分物质D(g) D.将容器的容积增大为原来的2倍
E. 保持体积不变通入1mol A
(4)能判断该反应已经达到化学平衡状态的是( )
A.恒容恒温时容器中气体压强保持不变
B.混合气体中D浓度不变
C.v(A)正 = v(A)逆
D.恒容时容器中气体密度不变
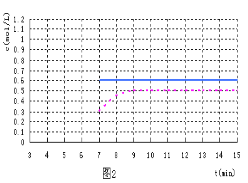
(5)反应达到平衡后,第7 min时,改变条件,在第9min达到新的平衡,在图2上作出第7 min至第15 min(作在答题纸上):下列情况下,D浓度变化图像
①若降低温度且平衡时D物质的量变化了0.4 mol (用虚线)
②若将容器的容积压缩为原来一半(用实线)
【答案】(1)0.1 mol/(L·min);2:1:3:1;(2)1.7;(3)C、E;(4)B、C、D;(5)关键点:起点在第7分钟,拐点在第9分钟
 。
。
【解析】
试题分析:(1)根据化学反应速率的定义,v(D)=0.6/(3×2)mol/(L·min)=0.1 mol/(L·min);化学反应速率之比等于化学计量数之比,因为是同条件同时间,因此物质的量变化之比等于化学计量数之比,m:n:p:q=(0.8-0.4):(1-0.8):0.6:0.2=2:1:3:1;(2)根据化学平衡常数定义,K = c3(D) / [c2(A) × c(B)] = 0.33 / (0.22 × 0.4)) = 1.7;(3)A、此正反应是放热反应,根据勒夏特列原理,升高温度,平衡向逆反应方向移动,B的转化率降低,故错误;B、通入B,增加反应物的浓度,平衡向正反应方向移动,但B的转化率降低,故错误;C、移出D,减少生成物的浓度,平衡向正反应方向移动,B的转化率增大,故正确;D、容积扩大,压强减小,反应前后气体系数之和相等,则平衡不移动,B的转化率不变,故错误;E、通入A,增大反应物浓度,平衡向正反应方向移动,B的转化率增大,故正确;(4)A、因为反应前后气体系数之和相等,压强始终相等,因此压强不变,不能说明达到平衡,故错误;B、根据化学平衡状态的定义,当组分浓度不再改变,说明达到平衡,故正确;C、根据化学平衡状态的定义,当正反应方向速率和逆反应方向速率相等,说明达到平衡,故正确;D、根据密度的定义,因为E为固体,因此气体质量减小,是恒容状态下,体积不变,因此密度不变,说明反应达到平衡,故正确;(5)①降低温度,平衡向正反应方向移动,D的物质的量浓度增加,D的物质的量变化了0.4mol,则达到平衡时D的物质的量浓度为0.5mol·L-1,②容积压缩为原来一半,压强增大,但平衡不移动,D的物质的量浓度为0.6mol·L-1,因此图像为: