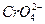题目内容
已知硫化氢气体可与溴水反应生成硫,下图是用来制取硫化氢并比较硫元素、溴元素非金属性强弱的实验装置。
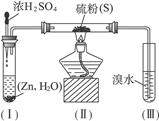
(1)将下列操作步骤补充完整:
①______________________________________________;
②用大火加热使硫沸腾与H2化合;
③______________________________________________;
④停止加热并做善后处理。
(2)装置(Ⅰ)中制氢气不直接用稀硫酸与锌反应,而将浓H2SO4滴入水中,其优点是__________________________________。
(3)装置(Ⅲ)中发生的现象是_______________________________,由此得出的结论是_____________________,反应的离子方程式为____________________________________。

(1)将下列操作步骤补充完整:
①______________________________________________;
②用大火加热使硫沸腾与H2化合;
③______________________________________________;
④停止加热并做善后处理。
(2)装置(Ⅰ)中制氢气不直接用稀硫酸与锌反应,而将浓H2SO4滴入水中,其优点是__________________________________。
(3)装置(Ⅲ)中发生的现象是_______________________________,由此得出的结论是_____________________,反应的离子方程式为____________________________________。
(1)①检查装置气密性,挤压胶头滴管使浓H2SO4滴入试管,并检验H2的纯度
③待装置(Ⅲ)中的溴水褪色,并产生浑浊时撤去导管
(2)利用浓H2SO4溶于水时放出的热,加速H2的生成
(3)溴水褪色,产生淡黄色浑浊 溴的非金属性比硫强Br2+H2S====S↓+2H++2Br-
③待装置(Ⅲ)中的溴水褪色,并产生浑浊时撤去导管
(2)利用浓H2SO4溶于水时放出的热,加速H2的生成
(3)溴水褪色,产生淡黄色浑浊 溴的非金属性比硫强Br2+H2S====S↓+2H++2Br-
由于H2S有毒,H2易燃易爆,因此操作的第一步应是检查装置气密性和检验H2的纯度,反应结束时,为防止(Ⅲ)内液体被倒吸,应先撤去导管再停止加热 。用浓H2SO4与用稀H2SO4的区别在于浓H2SO4有一个稀释的过程,其稀释时放出大量热,可以加快反应的进行。

练习册系列答案
相关题目
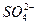 、
、 、S2-、Cl-、Br-、I-、
、S2-、Cl-、Br-、I-、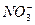 、Na+、Mg2+等离子。
、Na+、Mg2+等离子。 KOH+I2+O2(未配平),由此可得出下列结论正确的是( )?
KOH+I2+O2(未配平),由此可得出下列结论正确的是( )?