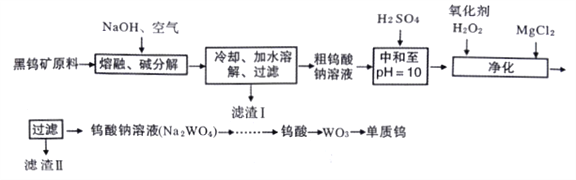
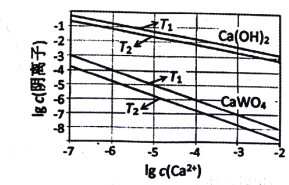
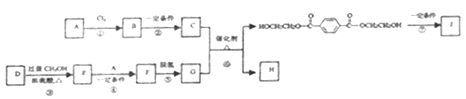
题目内容
【题目】(12分)有X、Y、Z三种短周期元素,已知X的气态氢化物的分子式为H2X,该氢化物的相对分子质量与X最高价氧化物的相对分子质量之比为17∶40,X原子核内质子数与中子数相等;Y与X可形成离子化合物Y2X,Y的阳离子的电子层结构与Ne相同。Z与X处于同一周期,其气态单质是双原子分子,两原子共用一对电子。
(1)写出各元素的符号:X______,Y______,Z______。
(2)X的相对原子质量为____________,其离子的结构示意图为________。
(3)Y单质在空气中燃烧的化学方程式是________________________,该生成物与水反应的化学方程式是______________________。
(4)X与氢气化合的产物的电子式为________。
【答案】 S Na Cl 32 ![]() 2Na+O2
2Na+O2![]() Na2O2 2Na2O2+2H2O===4NaOH+O2↑ H
Na2O2 2Na2O2+2H2O===4NaOH+O2↑ H ![]()
【解析】试题分析:X的气态氢化物的分子式为H2X,则X的最低价是-2,最高价是+6,X最高价氧化物的化学式为XO3,该氢化物的相对分子质量与X最高价氧化物的相对分子质量之比为17∶40,即![]() ,x=32,X原子核内质子数与中子数相等,x是S元素。Y与X可形成离子化合物Y2X,Y是+1价元素,Y的阳离子的电子层结构与Ne相同,故Y是Na元素;Z与X处于同一周期,其气态单质是双原子分子,两原子共用一对电子,Z是Cl元素。
,x=32,X原子核内质子数与中子数相等,x是S元素。Y与X可形成离子化合物Y2X,Y是+1价元素,Y的阳离子的电子层结构与Ne相同,故Y是Na元素;Z与X处于同一周期,其气态单质是双原子分子,两原子共用一对电子,Z是Cl元素。
解析:根据以上分析,(1)各元素的符号:X是 S,Y是Na,Z是Cl。
(2)S的相对原子质量为32, ![]() 的结构示意图为
的结构示意图为![]() 。
。
(3)钠在空气中燃烧生成过氧化钠的化学方程式是2Na+O2 ![]() Na2O2,过氧化钠与水反应生成氢氧化钠和氧气,化学方程式是2Na2O2+2H2O===4NaOH+O2↑。
Na2O2,过氧化钠与水反应生成氢氧化钠和氧气,化学方程式是2Na2O2+2H2O===4NaOH+O2↑。
(4)S与氢气生成硫化氢,硫化氢的电子式为![]() 。
。

【题目】苯甲酸乙酯可用作食用香料。某小组用如下装置制备苯甲酸乙酯
反应原理: (苯甲酸乙酯)+H2O
(苯甲酸乙酯)+H2O
产物和部分反应物相关数据如下:
物质 | 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
熔点/℃ | 122.1 | -117.3 | -34.6 |
沸点/℃ | 249 | 78.3 | 213 |

实验步骤:
①在B中加入的物质有:12.2g苯甲酸、10mL乙醇、10mL浓硫酸和沸石;
②按图甲安装好仪器,水浴加热,回流2小时;
③冷却后将B中液体与30mL水混合,并分批加入碳酸钠粉末;
④分液,取出有机层并加入适量MgSO4摇匀;
⑤按图乙装置安好仪器,加热精馏④所得有机物,收集产品。
回答下列问题:
(1)仪器C的名称______________。
(2)步骤① 若加热后才发现未加沸石,应采取的措施是________;步骤② 采取水浴加热的优点是______。
(3)步骤③ 为了预防液体因瞬时放出大量热而飞溅,将有机物与水混合的操作是____________。
(4)步骤④分液时除了要用到烧杯,还需要的主要玻璃仪器有__________,使用该仪器之前需要进行的操作是__________;无水MgSO4的作用是___________。
(5)步骤⑤收集馏分应控制的最佳温度为____________。
(6)为了提高苯甲酸乙酯的产率,可以采取的措施_________(任填一种)。