题目内容
【题目】常温下,0.1mol·L﹣1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A.该混合溶液pH=7.0
B.原HA溶液中:c(HA)>c(H+)>c(A﹣)
C.图中X表示HA,Y表示OH﹣,Z表示H+
D.混合溶液中:c(X)+x(A﹣)=c(K+)
【答案】B
【解析】
试题分析:一元酸HA和KOH溶液等体积、等浓度混合,二者恰好反应:HA+KOH=KA+H2O,所得溶液为KA溶液。A.由示意图可知,所得的KA溶液中中A-浓度小于0.05mol/L,说明在溶液中存在A-+H2O![]() HA+OH-,KA水解呈碱性,则该混合液pH>7,故A错误;B.c(K+)>c(A-),说明KA水解,A-+H2O
HA+OH-,KA水解呈碱性,则该混合液pH>7,故A错误;B.c(K+)>c(A-),说明KA水解,A-+H2O![]() HA+OH-,所以HA为弱酸,则原HA溶液中:c(HA)>c(H+)>c(A﹣),故B正确;C.HA是弱电解质,则有c(A-)>c(OH-),c(OH-)除了水解产生的还有水电离的,因此c(OH-)>c(HA),所以有:c(K+)>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,故C错误;D.溶液中存在物料守恒c(K+)=c(A-)+c(HA),Y表示HA,得到c(A-)+c(Y)=c(K+),故D错误;故选B。
HA+OH-,所以HA为弱酸,则原HA溶液中:c(HA)>c(H+)>c(A﹣),故B正确;C.HA是弱电解质,则有c(A-)>c(OH-),c(OH-)除了水解产生的还有水电离的,因此c(OH-)>c(HA),所以有:c(K+)>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,故C错误;D.溶液中存在物料守恒c(K+)=c(A-)+c(HA),Y表示HA,得到c(A-)+c(Y)=c(K+),故D错误;故选B。

 每课必练系列答案
每课必练系列答案【题目】原电池是化学对人类的一项重大贡献。
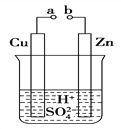
(1)某兴趣小组为研究原电池原理,设计如图A装置。
|
|
A | B |
①a和b不连接时,烧杯中发生反应的离子方程式是 _________________________。
②a和b用导线连接,Cu极为原电池________极(填“正”或“负”),该电极反应式是____________________。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.2 mol电子, 则理论上Zn片质量减轻________g。
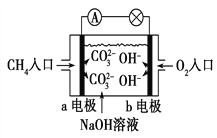
(2)如图是甲烷燃料电池原理示意图B,回答下列问题:
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为: _________________________。
②电池工作一段时间后电解质溶液的pH__________(填“增大”“减小”或“不变”)。