题目内容
下列说法正确的是
| A.除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤 |
| B.某温度时,纯水中c(H+)=2×10-7mol·L-1,则c(OH-)=5×10-8mol·L-1 |
C.N2(g)+3H2(g) 2NH3(g),其他条件不变,增大压强,v(正)增大而v(逆)减小 2NH3(g),其他条件不变,增大压强,v(正)增大而v(逆)减小 |
D.Na2CO3溶液中存在平衡:CO32-+H2O HCO3-+OH一,升高温度溶液碱性增强 HCO3-+OH一,升高温度溶液碱性增强 |
D
试题分析:A、苯酚与溴水生成三溴苯酚白色沉淀能溶于苯,应将溴水改成氢氧化钠溶液后分液,错误;B、水电离生成的c(H+)=c(OH-),错误;C、增大压强,正、逆反应速率均加快,错误;D、水解反应是吸热反应,升高温度,平衡向右移动,c(OH-)增大,碱性增强,正确。

练习册系列答案
相关题目
 CH3OH(g)
CH3OH(g) xC(g) △H<0。测得两容器中c(A)随时间t的变化如上图所示,下列说法不正确的是
xC(g) △H<0。测得两容器中c(A)随时间t的变化如上图所示,下列说法不正确的是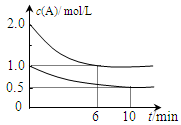
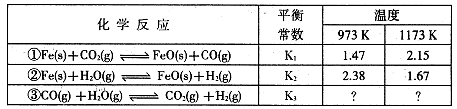
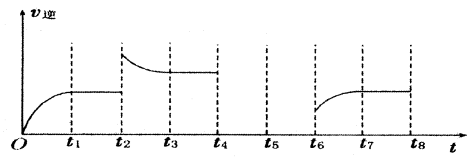
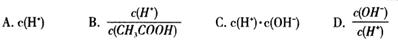
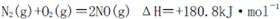 是导致汽车尾 气中含有NO的重要原因之一。
是导致汽车尾 气中含有NO的重要原因之一。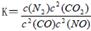 ,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表
,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表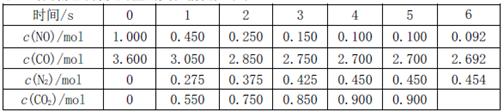
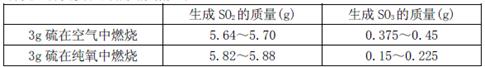
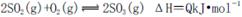 向右移动
向右移动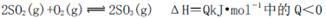
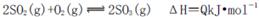 向右移动
向右移动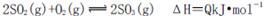 向右移动
向右移动 pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是 2 SO3(g)。已知反应过程某一时刻SO2、O2、SO3浓度(mol?L-1)分别为0.2、0.1、0.2,达到平衡时,浓度可能正确的是( )
2 SO3(g)。已知反应过程某一时刻SO2、O2、SO3浓度(mol?L-1)分别为0.2、0.1、0.2,达到平衡时,浓度可能正确的是( ) H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
 2CO (g)平衡常数K1;
2CO (g)平衡常数K1; CO(g) +H2 (g)平衡常数K2则K、K1、K2,之间的关系是 :
CO(g) +H2 (g)平衡常数K2则K、K1、K2,之间的关系是 : 2SCl2(l) ΔH=-50.16 kJ·mol-1
2SCl2(l) ΔH=-50.16 kJ·mol-1