题目内容
在固定体积的密闭容器中进行如下反应:2SO2(g) + O2(g)  2 SO3(g)。已知反应过程某一时刻SO2、O2、SO3浓度(mol?L-1)分别为0.2、0.1、0.2,达到平衡时,浓度可能正确的是( )
2 SO3(g)。已知反应过程某一时刻SO2、O2、SO3浓度(mol?L-1)分别为0.2、0.1、0.2,达到平衡时,浓度可能正确的是( )
 2 SO3(g)。已知反应过程某一时刻SO2、O2、SO3浓度(mol?L-1)分别为0.2、0.1、0.2,达到平衡时,浓度可能正确的是( )
2 SO3(g)。已知反应过程某一时刻SO2、O2、SO3浓度(mol?L-1)分别为0.2、0.1、0.2,达到平衡时,浓度可能正确的是( )| A.SO2、O2分别为0.4mol?L-1、0.2mol?L-1 | B.SO2为0.25mol?L-1 |
| C.SO2、SO3均为0.15mol?L-1 | D.SO3为0.4mol?L-1 |
B
试题分析:用假设法、三行数据法先求逆反应进行到底时各组分浓度的极限值,再求正反应进行到底时各组分浓度的极限值,然后根据可逆反应不能进行到底或转化率不可能是100%判断各组分浓度的取值范围,从而确定答案。先假设逆反应进行到底,则:
2SO2(g) + O2(g)
 2 SO3(g)
2 SO3(g)各组分的起始浓度/ mol?L-1 0.2 0.1 0.2
各组分的变化浓度/ mol?L-1 0.2 0.1 0.2
各组分的平衡浓度/ mol?L-1 0.4 0.2 0
再假设正反应进行到底,则:
2SO2(g) + O2(g)
 2 SO3(g)
2 SO3(g)各组分的起始浓度/ mol?L-1 0.2 0.1 0.2
各组分的变化浓度/ mol?L-1 0.2 0.1 0.2
各组分的平衡浓度/ mol?L-1 0 0 0.4
由于正、逆反应都不可能进行到底,则达到平衡时二氧化硫的浓度:0<c(SO2)<0.4 mol?L-1,氧气的浓度:0<c(O2)<0.2 mol?L-1,三氧化硫的浓度:0<c(SO3)<0.4 mol?L-1,故AD均错,B正确;若二氧化硫的浓度减小,说明反应正向进行,则三氧化硫的浓度增大,不可能二者同时减小,故C错。

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
 2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。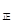 v
v (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。 ,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____ 。
,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____ 。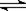 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是 2NH3(g),其他条件不变,增大压强,v(正)增大而v(逆)减小
2NH3(g),其他条件不变,增大压强,v(正)增大而v(逆)减小 HCO3-+OH一,升高温度溶液碱性增强
HCO3-+OH一,升高温度溶液碱性增强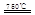 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg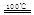 HgBr2+H2
HgBr2+H2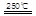 _____ + ④2HgO
_____ + ④2HgO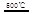 2Hg+O2↑
2Hg+O2↑ CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是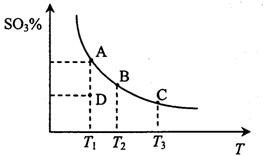
 cZ(g)的影响,将X和Y以物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是
cZ(g)的影响,将X和Y以物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是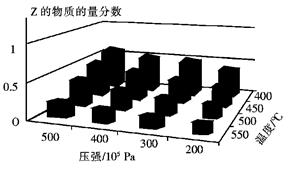
 N2O4(g) 达到平衡的标志是
N2O4(g) 达到平衡的标志是  pC(g)+qD(g)。若增大压强或升高温度,重新达到平衡,随时间变化过程均如图所示,则对该反应的叙述中正确的是( )
pC(g)+qD(g)。若增大压强或升高温度,重新达到平衡,随时间变化过程均如图所示,则对该反应的叙述中正确的是( )