题目内容
向一定量的Fe、FeO、Fe2O3混合物中加入1.00mol/l的盐酸100ml,可恰好使混合物完全溶解,放出224ml标准状况下的气体,向所得溶液中加入硫氰化钾,无血红色出现。
(1)若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量是多少?
(2)求原混合物中铁元素的质量分数 。
(1)若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量是多少?
(2)求原混合物中铁元素的质量分数 。
(1)最终溶液为FeCl2
故n(Fe)= n(FeCl2)=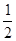 n(Cl-)=
n(Cl-)=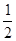 n(HCl)=
n(HCl)=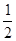 × 1.00mol/L×0.1L=0.05mol
× 1.00mol/L×0.1L=0.05mol
m(Fe)=0.05mol×56g/mol=2.8g
(2)HCl中H元素反应后一部分转化成H2,另一部分转化到H2O中,
故n(O)=n(H2O)=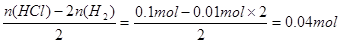
∴m(O)=0.64g
所以w(Fe)=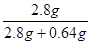 ×%=81.4%
×%=81.4%
故n(Fe)= n(FeCl2)=
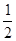 n(Cl-)=
n(Cl-)=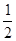 n(HCl)=
n(HCl)=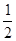 × 1.00mol/L×0.1L=0.05mol
× 1.00mol/L×0.1L=0.05molm(Fe)=0.05mol×56g/mol=2.8g
(2)HCl中H元素反应后一部分转化成H2,另一部分转化到H2O中,
故n(O)=n(H2O)=
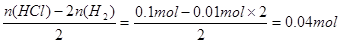
∴m(O)=0.64g
所以w(Fe)=
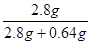 ×%=81.4%
×%=81.4%本题重点考查守恒法在化学计算中的应用
(1)混合物与盐酸恰好反应,所得溶液加入硫氰化钾,无血红色出现,说明没有Fe3+,故溶质只能为FeCl2,由氯元素的守恒可得:n(FeCl2)=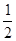 n(Cl-)=
n(Cl-)=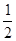 n(HCl)=
n(HCl)=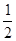 × 1.00mol/L×0.1L=0.05mol,再由铁的守恒可知:n(Fe)= n(FeCl2)=0.05mol
× 1.00mol/L×0.1L=0.05mol,再由铁的守恒可知:n(Fe)= n(FeCl2)=0.05mol
(2)混合物与盐酸反应中,盐酸中的H元素一部分被置换生成氢气,别一部分与混合物中的氧元素结合生成水。故生成的水的物质的量为:n(H2O)=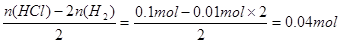
也就是混合物中氧元素的物质的量:n(O)=n(H2O)=0.04mol,质量为:m(O)=0.64g
综合可知,原混合物中铁元素的质量分数为:w(Fe)=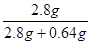 ×%=81.4%
×%=81.4%
(1)混合物与盐酸恰好反应,所得溶液加入硫氰化钾,无血红色出现,说明没有Fe3+,故溶质只能为FeCl2,由氯元素的守恒可得:n(FeCl2)=
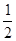 n(Cl-)=
n(Cl-)=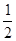 n(HCl)=
n(HCl)=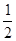 × 1.00mol/L×0.1L=0.05mol,再由铁的守恒可知:n(Fe)= n(FeCl2)=0.05mol
× 1.00mol/L×0.1L=0.05mol,再由铁的守恒可知:n(Fe)= n(FeCl2)=0.05mol(2)混合物与盐酸反应中,盐酸中的H元素一部分被置换生成氢气,别一部分与混合物中的氧元素结合生成水。故生成的水的物质的量为:n(H2O)=
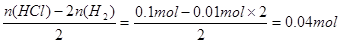
也就是混合物中氧元素的物质的量:n(O)=n(H2O)=0.04mol,质量为:m(O)=0.64g
综合可知,原混合物中铁元素的质量分数为:w(Fe)=
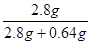 ×%=81.4%
×%=81.4%
练习册系列答案
相关题目
 4
4  的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。
的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。 g,在溶液中再滴人稀硫酸后,剩余金属为
g,在溶液中再滴人稀硫酸后,剩余金属为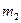 g,则
g,则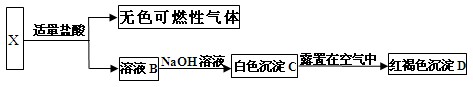
 米铜”比铜片更易失去电子
米铜”比铜片更易失去电子 l,则溶液中H+离子同时减少 ( )
l,则溶液中H+离子同时减少 ( )