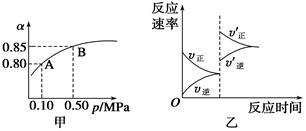
题目内容
将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0。当反应进行到时间t0时达到平衡状态,测得混合气体的总物质的量为2.1 mol。试回答:
2SO3(g);ΔH<0。当反应进行到时间t0时达到平衡状态,测得混合气体的总物质的量为2.1 mol。试回答:
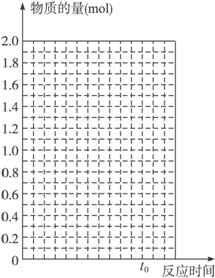
(1)在上图中作出反应混合物中各组分气体的物质的量随反应进行到t0时的变化曲线。
(2)当反应进行到t1时间时(t1 >t0),给上述反应容器加热到温度为T2(T2>T1),反应在t3时间时(t3>t1)重新达到平衡状态,新平衡混合物中气体的总物质的量________2.1 mol(填“<”“>”或“=”)。
(3)若起始时加入0.6 mol SO2、0.3 mol O2和x mol SO3,保持温度不变,达到平衡状态后,各气体的体积分数与上述平衡状态相同,x的值为__________。
(1)如图所示
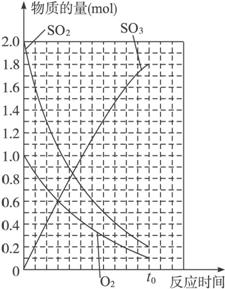
(2)>
(3)任意值
解析:(1)t0时,SO2 0.2 mol 、O2 0.1 mol、SO3 1.8 mol,变化曲线如图所示。(2)升高温度,化学平衡逆移,气体总的物质的量增大,会大于2.1 mol。(3)等压过程建立等效平衡只需反应物的起始量成等比,与x的值无关,故x的值可为任意值。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(14分) 硫酸是工业生产中一种重要的化工产品,我国工业生产硫酸的主要方法是接触法,主要原料为黄铁矿,请回答下列问题:
(1)已知煅烧黄铁矿的化学方程式为 4FeS2 + 11O2
该反应中氧化剂和氧化产物之比为 ;标准状态下得到4.48升SO2 时,一共转移了 mol e-。(每空3分)
(2)已知温度、压强对SO2平衡转化率的影响如下表所示:根据上表回答,SO2转化到SO3的
最佳反应条件是 。(每空2分)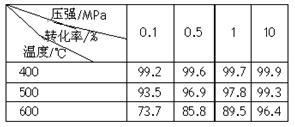
| A.400-500℃ 0.1 MPa | B.400℃10 MPa |
| C.500℃10 MPa | D.400-500℃1 MPa |
(4)市售浓硫酸的密度是1.84 g / cm3、质量分数为98 % ,若用H2SO4· XH2O来表示这种浓硫酸,则X为 。(每空2分)
 2SO3(g),下列哪些量不再变化时,并不能说明化学反应已达平衡状态( )
2SO3(g),下列哪些量不再变化时,并不能说明化学反应已达平衡状态( ) 2SO3(g) ΔH<0。某温度下,将2 mol SO2和
2SO3(g) ΔH<0。某温度下,将2 mol SO2和