题目内容
将2 mol SO2和1 mol O2充入一容积固定的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) 2SO3(g),下列哪些量不再变化时,并不能说明化学反应已达平衡状态( )
2SO3(g),下列哪些量不再变化时,并不能说明化学反应已达平衡状态( )
A.混合气体的密度 B.混合气体的压强
C.混合气体的总物质的量 D.混合气体的平均相对分子质量
A
【解析】
试题分析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,A不能说明;该反应是体积减小的可逆反应,在反应过程中气体的总物质的量和压强也是减小的,因此当气体的总物质的量和压强不再发生变化时,可以说明得到平衡状态;混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,因此选项D可以说明,答案选A。
考点:考查可逆反应平衡状态的判断
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案(14分) 硫酸是工业生产中一种重要的化工产品,我国工业生产硫酸的主要方法是接触法,主要原料为黄铁矿,请回答下列问题:
(1)已知煅烧黄铁矿的化学方程式为 4FeS2 + 11O2
该反应中氧化剂和氧化产物之比为 ;标准状态下得到4.48升SO2 时,一共转移了 mol e-。(每空3分)
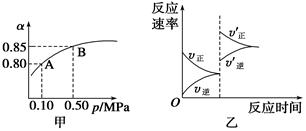
(2)已知温度、压强对SO2平衡转化率的影响如下表所示:根据上表回答,SO2转化到SO3的
最佳反应条件是 。(每空2分)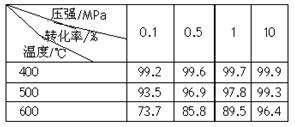
| A.400-500℃ 0.1 MPa | B.400℃10 MPa |
| C.500℃10 MPa | D.400-500℃1 MPa |
(4)市售浓硫酸的密度是1.84 g / cm3、质量分数为98 % ,若用H2SO4· XH2O来表示这种浓硫酸,则X为 。(每空2分)
 2SO3(g) ΔH<0。某温度下,将2 mol SO2和
2SO3(g) ΔH<0。某温度下,将2 mol SO2和