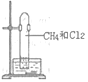
题目内容
【题目】第三周期元素X、Y、Z、W的最高价氧化物分别溶于水得溶液,0.010mol/L的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是( )
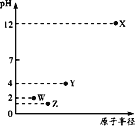
A.Y可能是硅元素
B.简单离子半径:Z>W>X
C.气态氢化物的稳定性:Y>W
D.非金属性:Y>Z
【答案】B
【解析】
第三周期元素中,X最高价氧化物水化物的溶液的pH为12,氢氧根浓度为0.01mol/L,故为一元强碱,则X为Na,Y、W、Z对应的最高价氧化物水化物的溶液pH均小于7,均为酸,W最高价含氧酸溶液中氢离子浓度为0.01mol/L,故为一元强酸,则W为Cl元素;等浓度的最高价含氧酸中,Z电离出氢离子浓度比W的大、Y对应的酸性最弱,而原子半径Y>Z>Cl,故Z为S元素,Y为P元素,以此来解答。
由上述分析可知,X为Na、Y为P、Z为S,W为Cl,
A.Y不可能是Si元素,因为SiO2不溶于水,由分析可知Y是P元素,故A错误;
B.电子层越多,离子半径越大,具有相同排布的离子中原子序数大的离子半径小,则S2-、Cl-和Na+的离子半径为S2->Cl->Na+,故B正确;
C.Cl的非金属性比P强,则气态氢化物的稳定性HCl>PH3,故C错误;
D.S和P是同周期的主族元素,核电荷数大,元素的非金属性强,即S的非金属性大于P,故D错误;
故答案为B。

练习册系列答案
相关题目