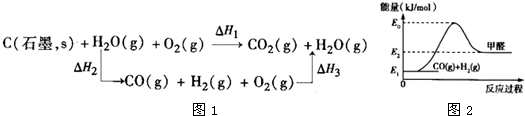题目内容
(3分)将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s) + H2O(g)=CO(g) + H2(g);△H1 。 已知:
①2H2(g) + O2(g) = 2H2O(g);△H2=-483.6kJ·mol-1
②2C(s) + O2(g) = 2 CO(g); △H3=-221.0kJ·mol-1
结合上述热化学方程式,计算得出△H1 = 。
【答案】
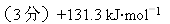
【解析】略

练习册系列答案
相关题目
2010年上海举办的世博会主打环保旗帜,下列行为中不符合这一主题的是( )
| A、大量?采地下水,以满足社会对水的需求 | B、减少直至不使用对大气臭氧层起破坏作用的氟氯烃 | C、?用“绿色化学”工艺,使原料尽可能转化为所需要的物质 | D、将煤转化为水煤气作燃料 |
 CO和H2与我们的生产和生活等方面密切相关.
CO和H2与我们的生产和生活等方面密切相关.