题目内容
 CO和H2与我们的生产和生活等方面密切相关.
CO和H2与我们的生产和生活等方面密切相关.(1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.
已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ.mol-1
H2(g)+
| 1 |
| 2 |
CO(g)+
| 1 |
| 2 |
则C(s)与水蒸气反应制取CO和H2的热化学方程式为
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ.mol-1
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ.mol-1
.标准状况下,V( CO):V(H2)=1:l的水煤气22.4L,完全燃烧生成CO2和水蒸气,放出的热量为262.5kJ
262.5kJ
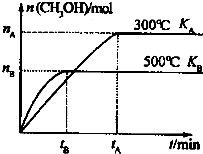
.(2)一定条件下,在容积为3L的密闭容器中发生反应:CO(g)+2H2(g)?CH3OH(g),达平衡状态.根据图示回答:
①500℃时,从反应开始至达到平衡状态V(H2)=
| 2nB |
| 3tB |
| 2nB |
| 3tB |
②KA 和KB的关系是:KA
>
>
KB,该反应的△H<
<
0(填“>”、“=”或“<”).③300℃达平衡时,将容器容积压缩到原来的
| 1 |
| 2 |
>
>
v(逆)(填“大于”、“等于”或“小于”).(3)室内煤气泄漏造成人体中毒,是因为CO吸入肺中与输氧血红蛋白(HbO2)发生反应:CO+HbO2?O2+HbCO,37℃时,K=220.当[HbCO]:[HbO2]≥0.02时,即吸入CO与O2物质的量浓度之比≥
1:11000
1:11000
时,人的智力会受损;把CO中毒的病人放入高压氧舱中解毒的原理是氧气浓度增大,上述化学平衡逆向移动,使CO从血红蛋白中脱离出来
氧气浓度增大,上述化学平衡逆向移动,使CO从血红蛋白中脱离出来
.分析:(1)利用盖斯定律计算C(s)与水蒸气反应制取CO和H2的反应热并书写热化学方程式,并利用热化学方程式计算反应放出的热量;
(2)①由图可计算用甲醇表示的化学反应速率,再利用反应速率之比等于化学计量数之比来计算氢气的反应速率;
②由图可知,温度低甲醇的物质的量多,则该反应为放热反应;
③300℃达平衡时,将容器容积压缩到原来的
,则压强增大,平衡正向移动;
(3)37℃时,K=220.当[HbCO]:[HbO2]≥0.02时,结合平衡常数分析CO与O2物质的量浓度之比;再利用平衡逆向分析移动CO中毒的病人放人高压氧舱中解毒的原理.
(2)①由图可计算用甲醇表示的化学反应速率,再利用反应速率之比等于化学计量数之比来计算氢气的反应速率;
②由图可知,温度低甲醇的物质的量多,则该反应为放热反应;
③300℃达平衡时,将容器容积压缩到原来的
| 1 |
| 2 |
(3)37℃时,K=220.当[HbCO]:[HbO2]≥0.02时,结合平衡常数分析CO与O2物质的量浓度之比;再利用平衡逆向分析移动CO中毒的病人放人高压氧舱中解毒的原理.
解答:解:(1)由①C(s)+O2(g)=CO2(g)△H=-393.5kJ.mol-1,
②H2(g)+
O2(g)=H2O(g)△H=-242.0kJ.mol-1,
③CO(g)+
O2(g)=CO2(g)△H=-283.0kJ.mol-1,
根据盖斯定律可知,①-②-③得C(s)+H2O(g)=CO(g)+H2(g)
△H=-393.5kJ.mol-1-(-242.0kJ.mol-1)-(-283.0kJ.mol-1)=+131.5kJ.mol-1,
标准状况下,V( CO):V(H2)=1:l的水煤气22.4L,由②③可知,
完全燃烧放出的热量为242kJ/mol×0.5mol+283kJ/mol×0.5mol=262.5kJ,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ.mol-1;262.5kJ;
(2)①由图可知甲醇表示的化学反应速率为
mol.L-1.min-1,由反应速率之比等于化学计量数之比可知氢气的反应速率为
mol.L-1.min-1,
故答案为:
mol.L-1.min-1;
②由图可知,温度低甲醇的物质的量多,则该反应为放热反应,△H<0,升高温度平衡逆向移动,则温度高,平衡常数变小,即KA>KB,
故答案为:>;<;
③300℃达平衡时,将容器容积压缩到原来的
,则压强增大,平衡正向移动,所以v(正)>v(逆),
故答案为:>;
(3)反应CO+HbO2?O2+HbCO,K=
,37℃时,K=220.当[HbCO]:[HbO2]≥0.02时,由平衡常数可知CO与O2物质的量浓度之比1:11000;
CO中毒的病人放入高压氧舱中,使氧气浓度增大,上述化学平衡逆向移动,使CO从血红蛋白中脱离出来,
故答案为:1:11000;氧气浓度增大,上述化学平衡逆向移动,使CO从血红蛋白中脱离出来.
②H2(g)+
| 1 |
| 2 |
③CO(g)+
| 1 |
| 2 |
根据盖斯定律可知,①-②-③得C(s)+H2O(g)=CO(g)+H2(g)
△H=-393.5kJ.mol-1-(-242.0kJ.mol-1)-(-283.0kJ.mol-1)=+131.5kJ.mol-1,
标准状况下,V( CO):V(H2)=1:l的水煤气22.4L,由②③可知,
完全燃烧放出的热量为242kJ/mol×0.5mol+283kJ/mol×0.5mol=262.5kJ,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ.mol-1;262.5kJ;
(2)①由图可知甲醇表示的化学反应速率为
| ||
| tBs |
| 2nB |
| 3tB |
故答案为:
| 2nB |
| 3tB |
②由图可知,温度低甲醇的物质的量多,则该反应为放热反应,△H<0,升高温度平衡逆向移动,则温度高,平衡常数变小,即KA>KB,
故答案为:>;<;
③300℃达平衡时,将容器容积压缩到原来的
| 1 |
| 2 |
故答案为:>;
(3)反应CO+HbO2?O2+HbCO,K=
| [HbCO]×[O2] |
| [CO]×[HbO2] |
CO中毒的病人放入高压氧舱中,使氧气浓度增大,上述化学平衡逆向移动,使CO从血红蛋白中脱离出来,
故答案为:1:11000;氧气浓度增大,上述化学平衡逆向移动,使CO从血红蛋白中脱离出来.
点评:本题考查知识点较多,注重对反应热的计算、反应速率的计算、化学平衡移动的分析,涉及图象与反应速率及平衡,题目难度中等,(3)为学生解答的易错点和难点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
有机物与我们的生产生活密切相关,下列说法不正确的是( )
| A、乙醇既可以作燃料,也可以在日常生活中使用,如无水乙醇经常用于杀菌、消毒 | B、苯是一种重要的化工原料,可发生取代反应制取氯苯、溴苯、苯磺酸等有机物 | C、油脂属于高级脂肪酸甘油酯,用油脂可以制造肥皂和油漆 | D、甲醛对人体有害,但甲醛的水溶液可用于标本的防腐,甲醛是制造酚醛树脂的原料 |
(8分)钠、镁、铝是重要的金属元素,与我们的生活和生产关系密切。
(1)元素的性质特别是化学性质取决于元素原子结构。钠离子的电子排布式为_______,铝元素的原子结构示意图为_________。
(2)钠、镁、铝元素的阳离子半径由小到大的顺序是_____________(用离子符号表示)。在短周期中非金属性最强的元素位于第____周期____族。
(3)钠、镁、铝的单质及其化合物在某些性质上存在着递变规律。下列有关说法正确的是___________(选填编号)。
a.三种元素的金属性越强,金属单质的熔点就越高
b.其碱性按NaOH、Mg(OH)2、Al(OH)3顺序依次减弱
c.常温下都能与浓硝酸剧烈反应生成硝酸盐,但剧烈程度依次减弱
d.等质量的钠、镁、铝与足量稀硫酸反应生成氢气的物质的量依次增加
(4)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定氟元素的电负性为4,并通过热化学方法建立了其他元素的电负性。第三周期主族元素的电负性如下:
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.8 |
2.1 |
2.5 |
3.0 |
从上表可以看出电负性的大小与元素非金属性的强弱关系是____________________;大量事实表明,当两种元素的χ值相差大于或等于1.7时,形成的化合物一般是离子化合物,根据此经验规律,AlBr3中的化学键类型应该是 。
 O2(g)=H2O(g)△H=-242.0kJ.mol-1
O2(g)=H2O(g)△H=-242.0kJ.mol-1 O2(g)=CO2(g)△H=-283.0kJ.mol-1
O2(g)=CO2(g)△H=-283.0kJ.mol-1 ,其他条件不变,则v(正)______v(逆)(填“大于”、“等于”或“小于”).
,其他条件不变,则v(正)______v(逆)(填“大于”、“等于”或“小于”).