题目内容
将煤转化为水煤气的主要化学反应为C(石墨,s)+H2O(g)═CO(g)+H2(g).已知:C(石墨,s)、H2(g)和CO(g)的燃烧热分别是393.5kJ/mol、285.8kJ/mol、283.0kJ/mol;H2O(g)=H2O(l)△H=-44.0kJ/mol.
请回答下列问题:
(1)根据以上数据,写出C(石墨,s)与水蒸气反应的热化学反应方程式:
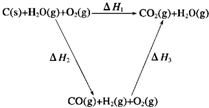
(2)比较反应热数据可知,1mol CO(g)和1mol H2(g)完全燃烧放出的热量之和比1mol C(石墨,s)完全燃烧放出的热量多.甲同学据此认为“煤转化为水煤气可以使燃烧放出更多的热量”;乙同学根据盖斯定律作出如图1所示循环图,并据此认为“煤转化为水煤气后再燃烧放出的热量与煤直接燃烧放出的热量相等”.
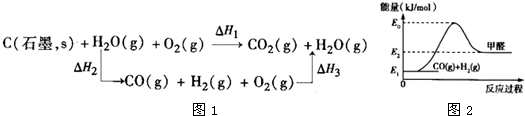
请评价甲、乙两同学的观点,正确的是
(3)人们把拆开1mol化学键所吸收的能量看成该化学键的键能.已知:石墨、O2分子中化学键的键能分别是460.7kJ/mol、497kJ/mol,则C=O键的键能为
(4)炼铁高炉中可将煤转化为CO再还原铁的氧化物,已知炼铁过程中有下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
②Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.4kJ/mol
由FeO固体得到Fe固体和CO2气体时对应的△H约为
(5)水煤气也是重要的有机化工原料.CO和H2在一定条件下可以合成甲醛,能满足“绿色化学”的要求,完全利用原料中的原子,实现零排放.该反应过程的能量变化如图2所示.该反应属于
请回答下列问题:
(1)根据以上数据,写出C(石墨,s)与水蒸气反应的热化学反应方程式:
C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol
C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol
.(2)比较反应热数据可知,1mol CO(g)和1mol H2(g)完全燃烧放出的热量之和比1mol C(石墨,s)完全燃烧放出的热量多.甲同学据此认为“煤转化为水煤气可以使燃烧放出更多的热量”;乙同学根据盖斯定律作出如图1所示循环图,并据此认为“煤转化为水煤气后再燃烧放出的热量与煤直接燃烧放出的热量相等”.
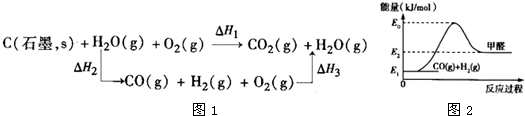
请评价甲、乙两同学的观点,正确的是
乙
乙
(填“甲”或“乙”),判断的理由是甲同学忽略了煤转化为水煤气要吸收热量
甲同学忽略了煤转化为水煤气要吸收热量
.(3)人们把拆开1mol化学键所吸收的能量看成该化学键的键能.已知:石墨、O2分子中化学键的键能分别是460.7kJ/mol、497kJ/mol,则C=O键的键能为
1136.3
1136.3
kJ/mol.(4)炼铁高炉中可将煤转化为CO再还原铁的氧化物,已知炼铁过程中有下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
②Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.4kJ/mol
由FeO固体得到Fe固体和CO2气体时对应的△H约为
-218.0
-218.0
kJ/mol.(5)水煤气也是重要的有机化工原料.CO和H2在一定条件下可以合成甲醛,能满足“绿色化学”的要求,完全利用原料中的原子,实现零排放.该反应过程的能量变化如图2所示.该反应属于
吸热
吸热
(填“吸热”或“放热”)反应,该反应的△H=反应物质的总能量-生成物的总能量
反应物质的总能量-生成物的总能量
.分析:(1)先根据燃烧热写出热化学方程式,然后根据盖斯定律来解答;
(2)根据盖斯定律:化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;根据煤转化为水煤气要吸收热量;
(3)根据反应热=反应物的总键能-生成物的总键能来解答;
(4)根据盖斯定律来解答;
(5)根据吸热反应中生成物的总能量大于反应物的总能量,反应热=反应物质的总能量-生成物的总能量;
(2)根据盖斯定律:化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;根据煤转化为水煤气要吸收热量;
(3)根据反应热=反应物的总键能-生成物的总键能来解答;
(4)根据盖斯定律来解答;
(5)根据吸热反应中生成物的总能量大于反应物的总能量,反应热=反应物质的总能量-生成物的总能量;
解答:解:(1)①C(石墨,s)+O2(g)=CO2(g)△H=-393.5 kJ/mol
②CO(g)+l/2O2(g)=CO2(g)△H=-283.0 kJ/mol
③H2(g)+l/2O2(g)=H2O(l)△H=-285.8kJ/mol
④H2O(g)=H2O(l)△H=-44.0kJ/mol.
根据盖斯定律,①-②-③+④得:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol,
故答案为:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol;
(2)化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;煤转化为水煤气要吸收热量;故答案为:乙;甲同学忽略了煤转化为水煤气要吸收热量;
(3)C(石墨,s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,石墨中每个碳原子与其他3个碳原子形成共价键,1个石墨中形成3个共价键,1个氧气中含有1个O=O,1个CO2中含有2个C=O,则△H=460.7kJ/mol×3+497kJ/mol-2×E(C=O)=-393.5 kJ/mol,E(C=O)=1136.3kJ/mol,故答案为:1136.3;
(4)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol ③
①×3-②-③×2得
6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+640.5kJ/mol)×2=-1308.0kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
故答案为:-218.0
(5)吸热反应中生成物的总能量大于反应物的总能量,反应热=反应物质的总能量-生成物的总能量,故答案为:吸热,反应物质的总能量-生成物的总能量;
②CO(g)+l/2O2(g)=CO2(g)△H=-283.0 kJ/mol
③H2(g)+l/2O2(g)=H2O(l)△H=-285.8kJ/mol
④H2O(g)=H2O(l)△H=-44.0kJ/mol.
根据盖斯定律,①-②-③+④得:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol,
故答案为:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol;
(2)化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;煤转化为水煤气要吸收热量;故答案为:乙;甲同学忽略了煤转化为水煤气要吸收热量;
(3)C(石墨,s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,石墨中每个碳原子与其他3个碳原子形成共价键,1个石墨中形成3个共价键,1个氧气中含有1个O=O,1个CO2中含有2个C=O,则△H=460.7kJ/mol×3+497kJ/mol-2×E(C=O)=-393.5 kJ/mol,E(C=O)=1136.3kJ/mol,故答案为:1136.3;
(4)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol ③
①×3-②-③×2得
6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+640.5kJ/mol)×2=-1308.0kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
故答案为:-218.0
(5)吸热反应中生成物的总能量大于反应物的总能量,反应热=反应物质的总能量-生成物的总能量,故答案为:吸热,反应物质的总能量-生成物的总能量;
点评:本题主要考查了盖斯定律的应用,难度不大,根据课本知识即可完成.

练习册系列答案
相关题目
党的十七大报告指出:“加强能源资源节约和生态环境保护,增强可持续发展能力,坚持节约资源和保护环境的基本国策,发展环保产业.”
(1)下列有关做法不符合上述要求的是________.
| A.将煤液化、气化,提高燃料的燃烧效率 |
B.安装汽车尾气催化转化装置,使之反应:4CO+2NO2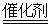 4CO2+N2 4CO2+N2 |
| C.大力推广乙醇汽油的同时,研究开发太阳能汽车和氢燃烧电池汽车 |
| D.在水力发电、火力发电、核能发电和风力发电中要大力发展火力发电 |
C(s)+H2O(g)
 CO(g)+H2(g);C(s)、H2(g)和CO(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、H2(g)和CO(g)完全燃烧的热化学方程式为:C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol ①
H2(g)+
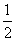 O2(g)===H2O(g) ΔH=-242.0 kJ/mol ②
O2(g)===H2O(g) ΔH=-242.0 kJ/mol ②CO(g)+
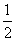 O2(g)===CO2(g) ΔH=-283.0 kJ/mol ③
O2(g)===CO2(g) ΔH=-283.0 kJ/mol ③请回答:
①根据以上数据,写出C(s)与H2O(g)反应的热化学方程式:_____________________________________.
②水煤气不仅是优良的气体燃料,也是重要的有机化工原料,CO和H2在一定条件下可以合成:a.甲醇;b.甲醛;c.甲酸;d.乙酸.试分析当CO和H2按1∶1的体积比混合反应,合成上述________(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放.
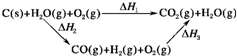
 4CO2+N2
4CO2+N2 CO(g)+H2(g);C(s)、H2(g)和CO(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、H2(g)和CO(g)完全燃烧的热化学方程式为: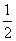 O2(g)===H2O(g) ΔH=-242.0 kJ/mol ②
O2(g)===H2O(g) ΔH=-242.0 kJ/mol ②