题目内容
【题目】综合利用海水可以制备食盐、纯碱、金属镁等钩质,其流程示意图如下:
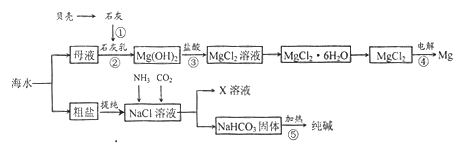
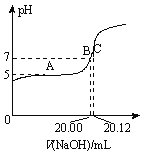
(1)在上述反应①~⑤中,没有涉及的化学反应类型是______。
A.分解反应 B.化合反应
C.复分解反应 D.置换反应
(2)写出反应③的离子方程式______________。
(3)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:
①溶解;
②依次加入过量的BaCl2溶液、NaOH溶液、_____________;
③过滤;
④______________;
⑤蒸发结晶。
其中加入过量氯化钡溶液的目的是____________________。
(4)X溶液中的主要阳离子是Na+和________________。
(5)检验纯碱样品中是否含NaCl应选用的试剂是______________。
【答案】 D Mg(OH)2+2H+=Mg2++2H2O Na2CO3溶液 在滤液中加适量盐酸调节溶液pH至7 使溶液中SO42-转化为沉淀而除去 NH4+ AgNO3溶液、稀硝酸
【解析】试题分析:(1)反应①是化合反应,②③属于复分解反应,属于化合反应,④属于分解反应、氧化还原反应,⑤分解反应;(2)酸碱中和反应,Mg (OH)2不溶于水写成化学式;(3)BaCl2溶液与Na2SO4反应生成硫酸钡沉淀;NaOH溶液与MgCl2反应生成氢氧化镁沉淀;CaCl2与Na2CO3溶液反应生成碳酸钙沉淀;过滤后的溶液含有氢氧化钠和碳酸钠杂质,除去沉淀后再加盐酸除去氢氧化钠和碳酸钠,然后通过蒸发结晶得到氯化钠晶体;氯化钠、氨气、二氧化碳、水反应生成碳酸氢钠沉淀和氯化铵;(5)检验纯碱样品中是否含NaCl,即检验是否存在氯离子;
解析:(1)在上述反应CaO+H2O=Ca(OH)2属于化合反应、MgCl2+ Ca(OH)2=Mg(OH)2+CaCl2属于复分解反应、Mg(OH)2+2HCl=MgCl2+2H2O属于复分解反应、MgCl2=Mg+Cl2属于分解反应、2NaHCO3=Na2CO3+CO2+H2O属于分解反应,没有涉及的化学反应类型是置换反应;(2)Mg (OH)2不溶于水写成化学式③的离子方程式为Mg(OH)2+2H+=Mg2++2H2O;(3)CaCl2与Na2CO3溶液反应生成碳酸钙沉淀,加入碳酸钠溶液除去氯化钙;④过滤后的溶液含有氢氧化钠和碳酸钠杂质,除去沉淀后加盐酸除去氢氧化钠和碳酸钠;加入BaCl2溶液目的是与Na2SO4反应生成硫酸钡沉淀,除去Na2SO4;(4)氯化钠、氨气、二氧化碳、水反应生成碳酸氢钠沉淀和氯化铵,X溶液中的主要阳离子是Na+和NH4+;检验纯碱样品中是否含NaCl的方法是,将纯碱样品溶于水,滴入AgNO3溶液、稀硝酸,若产生白色沉淀则含有NaCl。

【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s) + 4CO(g)![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表。
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表。
下列说法正确的是( )
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25℃时反应Ni(CO)4(g)![]() Ni(s) + 4CO(g)的平衡常数为0.5
Ni(s) + 4CO(g)的平衡常数为0.5
C. 在某条件下达到平衡,测得Ni(CO)4、CO浓度均为0.5mol·L-1,则此时温度高于80℃
D. 80℃达到平衡时,保持体积不变,往体系中充入一定量的CO,再次达到平衡后CO的体积分数减小