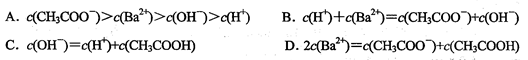题目内容
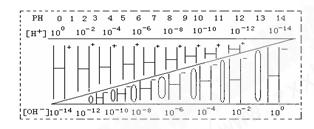
有下列四种溶液:①盐酸;②氯化铁;③氢氧化钠;④碳酸钠。它们的pH分别为4,4,10,10,溶液中水的电离度为α1,α2,α3,α4,则下列关系正确的是
| A.α1=α2>α3=α4 |
| B.α2=α4>α1=α3 |
| C.α1=α2=α3=α4 |
| D.α1=α3>α2=α4 |
B
反应H2O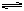 H++OH--Q;①向水中加入酸或碱,[H+]或[OH-]增大,平衡向左移动,抑制了水的电离,αH2O减小;②向水中加入能水解的盐,消耗H+或OH-,使平衡向右移动,促进水的电离,αH2O增大;③升高温度,平衡向右移动,αH2O增大;④向水中加入其他能与H+或OH-反应的物质,也能促进水的电离。如Na2O,Na等。题中给出了四种溶液的溶质及pH,要求排列电离度α的顺序。只要表示出水电离出来的[H+]水或[OH-]水,然后直接比较其大小即可。
H++OH--Q;①向水中加入酸或碱,[H+]或[OH-]增大,平衡向左移动,抑制了水的电离,αH2O减小;②向水中加入能水解的盐,消耗H+或OH-,使平衡向右移动,促进水的电离,αH2O增大;③升高温度,平衡向右移动,αH2O增大;④向水中加入其他能与H+或OH-反应的物质,也能促进水的电离。如Na2O,Na等。题中给出了四种溶液的溶质及pH,要求排列电离度α的顺序。只要表示出水电离出来的[H+]水或[OH-]水,然后直接比较其大小即可。
pH=4的盐酸:OH-为水电离产生的,[OH-]水=10-10mol/L
pH=4的FeCl3溶液,H+为水电离出来的,[H+]水=10-4mol/L
pH=10的Na2CO3溶液,OH-为水电离出来的,[OH-]=10-4mol/L
pH=10的NaOH溶液,H+为水电离出来的,[H+]=10-10mol/L
所以B的顺序是正确的。
 H++OH--Q;①向水中加入酸或碱,[H+]或[OH-]增大,平衡向左移动,抑制了水的电离,αH2O减小;②向水中加入能水解的盐,消耗H+或OH-,使平衡向右移动,促进水的电离,αH2O增大;③升高温度,平衡向右移动,αH2O增大;④向水中加入其他能与H+或OH-反应的物质,也能促进水的电离。如Na2O,Na等。题中给出了四种溶液的溶质及pH,要求排列电离度α的顺序。只要表示出水电离出来的[H+]水或[OH-]水,然后直接比较其大小即可。
H++OH--Q;①向水中加入酸或碱,[H+]或[OH-]增大,平衡向左移动,抑制了水的电离,αH2O减小;②向水中加入能水解的盐,消耗H+或OH-,使平衡向右移动,促进水的电离,αH2O增大;③升高温度,平衡向右移动,αH2O增大;④向水中加入其他能与H+或OH-反应的物质,也能促进水的电离。如Na2O,Na等。题中给出了四种溶液的溶质及pH,要求排列电离度α的顺序。只要表示出水电离出来的[H+]水或[OH-]水,然后直接比较其大小即可。pH=4的盐酸:OH-为水电离产生的,[OH-]水=10-10mol/L
pH=4的FeCl3溶液,H+为水电离出来的,[H+]水=10-4mol/L
pH=10的Na2CO3溶液,OH-为水电离出来的,[OH-]=10-4mol/L
pH=10的NaOH溶液,H+为水电离出来的,[H+]=10-10mol/L
所以B的顺序是正确的。

练习册系列答案
相关题目