题目内容
【题目】FeSO47H2O广泛用于医药和工业领域.以下是FeSO47H2O的实验室制备流程图. 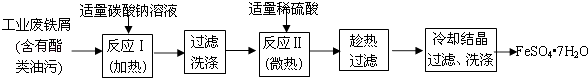
根据题意完成下列填空:
(1)碳酸钠溶液能除去酯类油污,是因为(用离子方程式表示),
(2)废铁屑中含氧化铁,无需在制备前除去,理由是(用离子方程式回答) , . 以下是测定某补血剂(FeSO47H2O)中铁元素含量的流程图.根据题意完成下列填空: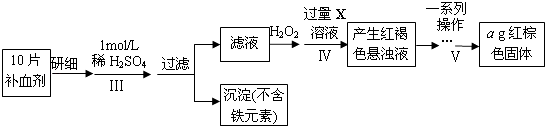
(3)步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及 .
(4)步骤Ⅴ一系列操作依次是:①过滤②洗涤③④冷却⑤称量⑥恒重操作.操作⑥的目的是 .
(5)假设实验无损耗,则每片补血剂含铁元素的质量g(用含a的代数式表示).
【答案】
(1)CO32﹣+H2O?HCO3﹣+OH﹣
(2)Fe2O3+6H+═2Fe3++3H2O;2Fe3++Fe═3Fe2+
(3)100mL容量瓶
(4)灼烧;确保氢氧化铁完全分解成了氧化铁
(5)0.07a
【解析】解:废铁屑中含有酯类油污,Na2CO3为强碱弱酸盐,CO32﹣水解生成HCO3﹣和OH﹣ , 升高促进CO32﹣水解,碱促进油脂水解,然后过滤洗涤,加入稀硫酸,发生反应II为Fe+H2SO4=FeSO4+H2↑,趁热过滤、冷却结晶,过滤洗涤得到FeSO47H2O;(1)Na2CO3为强碱弱酸盐,CO32﹣水解生成HCO3﹣和OH﹣ , 水解方程式为CO32﹣+H2OHCO3﹣+OH﹣ , 所以答案是:CO32﹣+H2OHCO3﹣和OH﹣;(2)废铁屑中含氧化铁,无需在制备前除去,因为氧化铁和酸反应生成铁盐,铁盐能被Fe还原生成亚铁盐,涉及的离子方程式为Fe2O3+6H+═2Fe3++3H2O、2Fe3++Fe═3Fe2+ , 所以答案是:Fe2O3+6H+═2Fe3++3H2O;2Fe3++Fe═3Fe2+;
将补血剂研细,向药片中加入稀硫酸,然后过滤得到沉淀,向滤液中加入双氧水,发生反应2Fe2++H2O2+2H+=2Fe3++2H2O,向溶液中加入过量X溶液生成红褐色沉淀,则X为碱,将红褐色沉淀灼烧得到红棕色固体Fe2O3 , (3)配制一定物质的量浓度的溶液时还需要100mL容量瓶,所以答案是:100mL容量瓶;(4)步骤Ⅴ一系列操作依次是:①过滤②洗涤③灼烧④冷却⑤称量⑥恒重操作,操作⑥的目的是确保氢氧化铁完全分解成了氧化铁,
所以答案是:灼烧(加热);确保氢氧化铁完全分解成了氧化铁;(5)ag中m(Fe)= ![]() ×ag=0.7ag,则每片药品中Fe的质量为0.07ag,
×ag=0.7ag,则每片药品中Fe的质量为0.07ag,
所以答案是:0.07a.
