题目内容
已知某物质X能发生如下转化: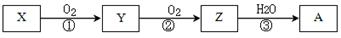
下列有关上述转化关系中物质及其反应的叙述错误的是
| A.若X为N2或NH3(催化氧化),则A为硝酸 |
| B.若X为S 或H2S(完全燃烧),则A为硫酸 |
| C.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y |
| D.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应 |
D
解析试题分析:A. 若X为N2或NH3(催化氧化),发生反应:N2+O2 2NO,4NH3+5O2
2NO,4NH3+5O2 4NO+6H2O;2NO+O2=2NO2;3NO2+ H2O = 2HNO3+ NO。则A为硝酸,正确。B.若X为S 或H2S(完全燃烧),S+ O2
4NO+6H2O;2NO+O2=2NO2;3NO2+ H2O = 2HNO3+ NO。则A为硝酸,正确。B.若X为S 或H2S(完全燃烧),S+ O2 SO2;2H2S+ 3O2
SO2;2H2S+ 3O2 2SO2+ 2H2O;2SO2+ O2
2SO2+ 2H2O;2SO2+ O2 2SO3;SO3+H2O= H2SO4则A为硫酸。正确。C.若X为非金属单质或非金属氢化物,如C或CH4,则它们发生不完全燃烧产生CO,CO燃烧得到CO2,CO2容易水产生的是碳酸,则碳酸不能与金属铜反应生成CO。若X是S或H2S,反应得到的浓硫酸与Cu在加热时可以反应得到SO2。因此A不一定能与金属铜反应生成Y。正确。D.反应①和②一定为氧化还原反应,反应③可能为氧化还原反应3NO2+ H2O = 2HNO3+ NO,也可能是非氧化还原反应如SO3+H2O= H2SO4。错误。
2SO3;SO3+H2O= H2SO4则A为硫酸。正确。C.若X为非金属单质或非金属氢化物,如C或CH4,则它们发生不完全燃烧产生CO,CO燃烧得到CO2,CO2容易水产生的是碳酸,则碳酸不能与金属铜反应生成CO。若X是S或H2S,反应得到的浓硫酸与Cu在加热时可以反应得到SO2。因此A不一定能与金属铜反应生成Y。正确。D.反应①和②一定为氧化还原反应,反应③可能为氧化还原反应3NO2+ H2O = 2HNO3+ NO,也可能是非氧化还原反应如SO3+H2O= H2SO4。错误。
考点:考查物质间的相互转化关系的知识。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案亚硝酸钠是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质或用途见图。下列说法不正确的是( )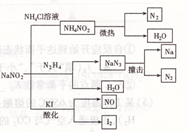
| A.NaNO2的稳定性大于NH4NO2 |
| B.NaNO2与N2 H4反应,NaNO2是氧化剂 |
| C.可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2 |
| D.NaN3分解,每产生1molN2转移6mole- |
[化学—选修2:化学与技术](15分)
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到硫酸,如橡胶的硫化、表面活性剂“烷基苯硫酸钠”的合成,铅蓄电池的生产等。工业上生产硫酸的流程图如下: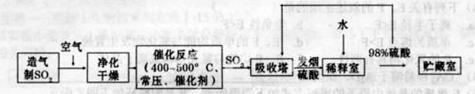

请回答下列问题
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,已知1g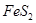 完全燃烧放出7.2kJ的热量
完全燃烧放出7.2kJ的热量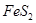 燃烧反应的热化学方程式_______ ______。
燃烧反应的热化学方程式_______ ______。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用在具有多层催化剂且又热交换的________(填仪器名称)中进行反应。在如图Ⅰ所示的装置中, A处气体进入装置前需净化的原因是 。
(3)精制炉气(含有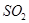 体积分数为7%、O2为11%、N2为82%)中
体积分数为7%、O2为11%、N2为82%)中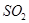 平衡 转化率与温度及压强关系如图2所示、在实际生产中,
平衡 转化率与温度及压强关系如图2所示、在实际生产中,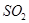 催化氧化反应的条件选择常压、
催化氧化反应的条件选择常压、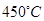 左右(对应图中A点):而没有选择
左右(对应图中A点):而没有选择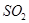 转化率更高的B或C点对应的反应条件,其原因分别是: 、 。
转化率更高的B或C点对应的反应条件,其原因分别是: 、 。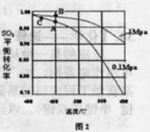
(4)已知:焙烧明矾的化学方程式4KAl(SO4)2?12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O。
焙烧711t明矾(M=474g/mol),若 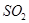 的利用率为95%,可生产质量分数为98%的硫酸 t。(结果保留小数点后一位)
的利用率为95%,可生产质量分数为98%的硫酸 t。(结果保留小数点后一位)
(5)除硫酸工业外,还有许多工业生产。下列相关的工业生产流程中正确的是
| A.向装置中通入氮气且保持体积不变 |
| B.向装置中通入氧气且保持体积不变 |
| C.添加更多的催化剂 |
| D.降低温度,及时转移SO3 |
研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示) 。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:
负极 ,正极 。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。(填序号)
| A.体系压强保持不变 | B.混合气体颜色保持不变 |
| C.SO3、NO的体积比保持不变 | D.每消耗 1 mol SO2,同时生成1 mol NO |
(4)工业常用Na2CO3饱和溶液回收NO、NO2气体:
NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2
若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为 。
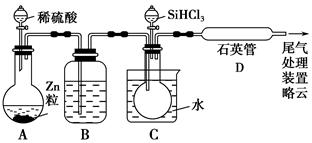
硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是 。
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有 。
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下: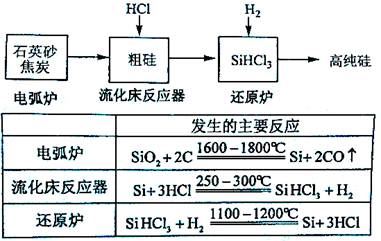
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为 ;碳化硅又称 ,其晶体结构与 相似。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 。
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
③SiHCl3极易水解,其完全水解的产物为 。
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是 。
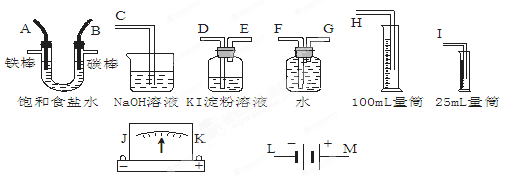

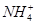 +OH-,NaOH晶体使该可逆反应的平衡向左移动
+OH-,NaOH晶体使该可逆反应的平衡向左移动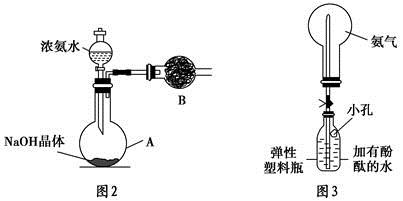
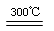 SiHCl3+H2;
SiHCl3+H2;