题目内容
[化学—选修2:化学与技术](15分)
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到硫酸,如橡胶的硫化、表面活性剂“烷基苯硫酸钠”的合成,铅蓄电池的生产等。工业上生产硫酸的流程图如下: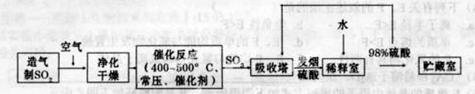

请回答下列问题
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,已知1g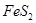 完全燃烧放出7.2kJ的热量
完全燃烧放出7.2kJ的热量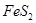 燃烧反应的热化学方程式_______ ______。
燃烧反应的热化学方程式_______ ______。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用在具有多层催化剂且又热交换的________(填仪器名称)中进行反应。在如图Ⅰ所示的装置中, A处气体进入装置前需净化的原因是 。
(3)精制炉气(含有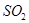 体积分数为7%、O2为11%、N2为82%)中
体积分数为7%、O2为11%、N2为82%)中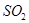 平衡 转化率与温度及压强关系如图2所示、在实际生产中,
平衡 转化率与温度及压强关系如图2所示、在实际生产中,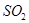 催化氧化反应的条件选择常压、
催化氧化反应的条件选择常压、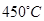 左右(对应图中A点):而没有选择
左右(对应图中A点):而没有选择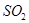 转化率更高的B或C点对应的反应条件,其原因分别是: 、 。
转化率更高的B或C点对应的反应条件,其原因分别是: 、 。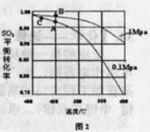
(4)已知:焙烧明矾的化学方程式4KAl(SO4)2?12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O。
焙烧711t明矾(M=474g/mol),若 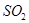 的利用率为95%,可生产质量分数为98%的硫酸 t。(结果保留小数点后一位)
的利用率为95%,可生产质量分数为98%的硫酸 t。(结果保留小数点后一位)
(5)除硫酸工业外,还有许多工业生产。下列相关的工业生产流程中正确的是
| A.向装置中通入氮气且保持体积不变 |
| B.向装置中通入氧气且保持体积不变 |
| C.添加更多的催化剂 |
| D.降低温度,及时转移SO3 |
(第四空3分,其余2分)
(1)4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3456kJ/mol
(2)接触室 防止催化剂中毒;水蒸气对设备和生产有不良影响
(3)不选B点,因为压强越大对设备的投资越大,消耗的动能大,二氧化硫原料的转化率在1个大气压时已达97%左右,再提高压强二氧化硫的转化率提高余地很小,所以采用1个大气压;
不选C点,因为温度越低,二氧化硫的转化率虽然更高,但是催化剂的催化效率受到影响,450°C时,催化剂的催化效率最高,所以选择A点,不选C点。
(4)320.6
(5)B
解析试题分析:(1)FeS2的摩尔质量是120g/mol,则4mol的FeS2完全燃烧放出的热量为7.2kJ×120×4=3456kJ,所以热化学方程式为4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3456kJ/mol
(2)二氧化硫转化为三氧化硫在接触室中进行;A处气体中含有杂质易使催化剂中毒,且水蒸气对设备和生产有不良影响,所以在进入接触室之前需净化;
(3)在反应2SO2+O2?2SO3中,SO2转化率较高,工业上一般不采用更高的压强,因为压强越大对设备的投资越大,消耗的动能越大.SO2的转化率在1个大气压下的转化率已达到97%左右,在提高压强,SO2的转化率提高的余地很小;本反应为放热反应,工业生产中不采取较低的温度,因为温度越低,SO2的转化率虽然更高,但催化剂的催化作用会受影响,450℃时,催化剂的催化效率最高。所以选择A点。
(4)根据明矾焙烧的化学方程式及元素守恒规律得:4KAl(SO4)2?12H2O~9SO2~9H2SO4,二氧化硫的利用率为95%,设焙烧711t明矾可生成98%的硫酸质量为x:4KAl(SO4)2?12H2O~9H2SO4,
4×474 9×98
711t×95% x×98%
解得x=320.6t
(5)A、通入与反应无关的气体,体积不变,压强增大,对平衡无影响,且对反应装置无利,错误;B、向装置中通入氧气且保持体积不变,可以增大氧气的浓度,反应速率加快,平衡正向移动,二氧化硫的转化率提高,对生产有利,正确;C、催化剂只能加快反应速率,不能改变平衡,错误;D、转移SO3减少生成物浓度,平衡正向移动,二氧化硫转化率提高,但温度降低会使催化剂的活性降低,反应速率减慢,对生产不利,错误,答案选B。
考点:考查工业中硫酸的制备,二氧化硫的催化氧化,反应的计算,化学平衡理论的应用

Na2O2、Cl2和SO2均能使品红溶液褪色(NA为阿伏加德罗常数的值)。下列说法正确的是
| A.Na2O2、Cl2、SO2使品红溶液褪色的原理相同 |
| B.标准状况下,1 mol Na2O2和22.4LCO2反应,转移电子数目为NA |
| C.等物质的量的Cl2和SO2同时通入品红溶液中,品红褪色更快 |
| D.在Na2O2中阴阳离子所含的电子数目相等 |
(13分)硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
(1)对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3组,则第2组中物质M的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、、Na2SO4、NaHSO4 |
(2)某校化学学习小组用下图所示的实验装置研究SO2的性质。
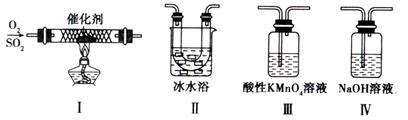
①在装置Ⅰ中发生SO2的催化氧化反应,其化学方程式是 。
②若按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,(已知:SO3熔点 16.8℃; SO2沸点—10℃。)装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+的同时pH降低,则该反应的离子方程式是 。
③若按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,如果装置Ⅳ中有30mL 2.5mol/LNaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是 。
已知某物质X能发生如下转化:
下列有关上述转化关系中物质及其反应的叙述错误的是
| A.若X为N2或NH3(催化氧化),则A为硝酸 |
| B.若X为S 或H2S(完全燃烧),则A为硫酸 |
| C.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y |
| D.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应 |
如何除去下列各粉末状混合物中的杂质(括号内为杂质),请选用下面提供的试剂和操作,将标号填在表内。
供选试剂:A盐酸;B烧碱溶液;C氧气;D水;ECO2;F不用其他试剂
供选操作:①加热;②加热熔融;③过滤;④结晶
| 含杂质的物质 | 所加试剂 | 主要操作 |
| (1)SiO2(NaHCO3) | | |
| (2)SiO2(CaCO3) | | |
| (3)SiO2(Si) | | |
| (4)NaCl(SiO2) | | |

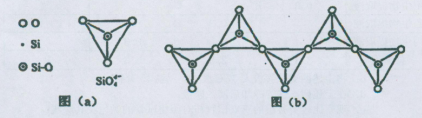

 2MgO+C,请填写以下空白:
2MgO+C,请填写以下空白: