题目内容
【题目】根据要求填空:
(1)A+和B-的电子层结构都与氩相同,A+的结构示意图为___;
(2)碳原子核外有___种能量不同的电子,分布在___个轨道中;
(3)鉴别碳原子可以利用其激发态原子跃迁到基态所形成的特征___(吸收或发射)光谱;
(4)水、SiO2、硫三种物质沸点由大到小的顺序为___;
(5)下列变化:H-(g)=H(g) +e-吸收的能量为73kJ·mol-1,H(g)=H+(g)+e-吸收的能量为1311kJ·mol-1,则氢负离子H-的第一电离能为___;
(6)短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。四种原子半径的由大到小顺序___(元素符号表示),能证明W、Z两元素非金属性强弱的离子方程式为___。
【答案】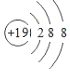 3 4 发射 SiO2>硫>水 73kJ/mol Mg>Si>S>O SiO32-+2H+=H2SiO3↓
3 4 发射 SiO2>硫>水 73kJ/mol Mg>Si>S>O SiO32-+2H+=H2SiO3↓
【解析】
根据离子核外电子排布规律画出结构示意图,判断轨道种类;根据光谱的形成原理分析解答;根据晶体的类型比较沸点大小;根据第一电离能的含义及题干信息计算第一电离能;根据核外电子排布规律推断元素种类,并根据元素周期律分析解答。
(1)设元素A的核电荷数是a,B元素原子的核电荷数为b,因为阴离子![]() 与阳离子
与阳离子![]() 电子层结构都与氩相同相同,即核外电子数相同,所以
电子层结构都与氩相同相同,即核外电子数相同,所以![]() ,
,![]() ,则
,则![]() 为
为![]() ,其结构示意图为:
,其结构示意图为: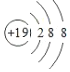 ,故答案为:
,故答案为: ;
;
(2)碳的电子排布式为![]() ,所以有3种能量不同的电子,p轨道上有2个电子,有2个纺锤形轨道,则核外共有轨道数4,故答案为:3;4;
,所以有3种能量不同的电子,p轨道上有2个电子,有2个纺锤形轨道,则核外共有轨道数4,故答案为:3;4;
(3)当碳原子从激发态跃迁到基态时,要发射能量,故答案为:发射;
(4)水常温下为液体,硫常温下为淡黄色粉末,为分子晶体,![]() 为原子晶体,水、
为原子晶体,水、![]() 、硫三种物质沸点由大到小的顺序为
、硫三种物质沸点由大到小的顺序为![]() 硫
硫![]() 水,故答案为:
水,故答案为:![]() 硫
硫![]() 水;
水;
(5)第一电离能为失去1个电子所吸收的能量,由![]() 吸收的能量为
吸收的能量为![]() ,可知氢负离子
,可知氢负离子![]() 的第一电离能为
的第一电离能为![]() ,故答案为:
,故答案为:![]() ;
;
(6)短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素;W与X属于同一主族,故W为S元素;Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素;Z单质可制成半导体材料,Z为Si元素;同周期自左而右,原子半径减小,同主族电子层越多原子半径越大,故原子半径![]() ,最高价氧化物对应水合物的酸性越强、氢化物稳定性越强,对应非金属元素的非金属性越强,在硅酸钠溶液中滴加稀硫酸,有白色沉淀生成,发生的离子反应为
,最高价氧化物对应水合物的酸性越强、氢化物稳定性越强,对应非金属元素的非金属性越强,在硅酸钠溶液中滴加稀硫酸,有白色沉淀生成,发生的离子反应为![]() ,体现硫酸酸性强于硅酸,可以证明S的非金属性大于Si,故答案为:
,体现硫酸酸性强于硅酸,可以证明S的非金属性大于Si,故答案为:![]() ;
;![]() 。
。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法错误的是( )
Y | |||
M | X | Z |
A.钠与Z可能形成Na2Z2化合物
B.由X与氧组成的物质在熔融时能导电
C.Y的最简单气态氢化物的热稳定性比X的强
D.M的简单离子半径是同周期中简单离子半径最小的