题目内容
【题目】实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热.图是实验室利用此反应制备氯气并进行一系列相关实验的装置(夹持设备已略).
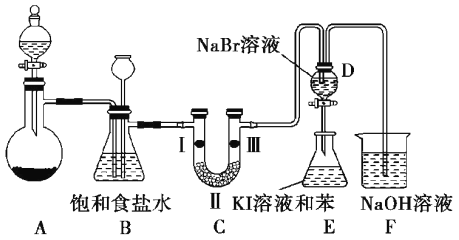
(1)上述反应中______ 是氧化剂,______ 是还原剂,若反应中氧化产物比还原产物多 1mol,则转移的电子数目为______ .
(2)装置B的作用是______ ,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:______ .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入______ (选“a”“b”或“c”)
a | b | c | |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E 的目的是为了比较Cl2、Br2、I2的氧化性强弱.已知 Br2的水溶液因浓度不同而呈现橙色或红棕色, I2难溶于水而易溶苯,且I2的苯溶液为紫红色.当向D中缓缓通入足量Cl2时,可以看到无色溶液逐渐变为红棕色,说明 Cl2的氧化性大于 Br2,请写出D中对应的离子方程式并用双线桥法表示出电子转移情况:______ .打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象______ (填“能”或“不能”)说明 Br2的氧化性大于I2.
(5)装置F的作用是除去污染性的物质(Cl2、Br2等),已知 Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3,且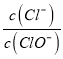 值与温度高低有关.若烧杯中装有 500mL0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水).
值与温度高低有关.若烧杯中装有 500mL0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水).
【答案】 KClO3 HCl 2.5NA 除杂和安全瓶 锥形瓶中的液面下降,长颈漏斗中的液面上升 c  不能 1.12
不能 1.12
【解析】(1)反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中KClO3中氯元素的化合价由+5价变成0价,HCl中氯元素的化合价由-1价变成0价,因此KClO3是氧化剂,HCl是还原剂,氯气既是氧化产物又是还原产物,其中氧化产物与还原产物的物质的量之比为5:1,若反应中氧化产物比还原产物多1mol,则生成氯气的物质的量为1.5mol,转移的电子数目为2.5NA;(2)盐酸易挥发,反应制取的氯气中含有氯化氢,装置B中饱和食盐水的作用是除去Cl2中的HCl;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大,B中长颈漏斗中液面上升,形成水柱;(3)装置C的实验目的是验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,根据图示装置可知,II中应该为固体干燥剂,氯气干燥后再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以答案选c;(4)D中对应的离子方程式为Cl2+2Br-=2Cl-+Br2,用双线桥法表示出电子转移情况为 ;氯气具有强氧化性,过量的氯气能够将碘离子氧化成碘单质,所以该现象不能说明溴的非金属性强于碘;(5)根据题意,Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3,无论生成的产物如何,钠原子与氯原子个数都相等,500mL0.2mol/L的NaOH溶液中含有NaOH的物质的量为0.1mol。根据守恒关系,氯气的物质的量为0.05mol,标况下的Cl2的体积为0.05mol×22.4L/mol=1.12L。
;氯气具有强氧化性,过量的氯气能够将碘离子氧化成碘单质,所以该现象不能说明溴的非金属性强于碘;(5)根据题意,Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3,无论生成的产物如何,钠原子与氯原子个数都相等,500mL0.2mol/L的NaOH溶液中含有NaOH的物质的量为0.1mol。根据守恒关系,氯气的物质的量为0.05mol,标况下的Cl2的体积为0.05mol×22.4L/mol=1.12L。

【题目】从下列实验事实所得出的相应结论正确的是
选项 | 实验事实 | 结论 |
A | Na2S2O3溶液与稀硫酸反应,其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度,化学反应速率加快 |
B | 在化学反应前后,催化剂的质量和化学性质都没有发生变化 | 催化剂一定不参与化学反应 |
C | H+浓度相同的盐酸和醋酸分别与等质量的形状相同的锌反应 | 前者速率快 |
D | 在容积可变的密闭容器中发生反应H2(g)+I2(g) | 正反应速率加快,逆反应速率不变 |
A. A B. B C. C D. D