题目内容
【题目】五种短周期元素X、Y、Z、M、W的原子序数与其某常见化合价的关系如右图所示,下列关系不正确的是
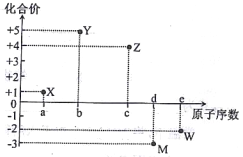
A. 元素X可能为锂
B. 原子半径大小:r(M)>r(w)
C. X2W中各原子均达8电子稳定结构
D. 元素气态氢化物的稳定性:YH3>MH3
【答案】C
【解析】由X的化合价为+1价,属于第IA族元素;Y的化合价为+5价,属于第VA族元素;Z的化合价为+4价,为第IVA族元素;M为的化合价为-3价,属于第VA族元素;W的化合价为-2价,属于第VIA族元素;由图知原子数:X<Y<Z<M<W,Y、M同主族,Y的原子序数小,所以Y为N元素、M为P元素;X的原子序数小于N,则X为H或Li,Z的原子序数大于N,属于第VIA族,则Z为Si元素;W原子序数大于P,则W为S元素;A.由分析可以知道,元素X可能为锂,所以A选项是正确的;B.M为P元素,W为S元素,同周期原子半径从左到右依次减小,则原子半径大小r(M)>r(w),所以B选项是正确的;C.X为H或Li,X2W中X原子不是8电子稳定结构,故C错误;D.元素的非金属性:Y>M,则元素气态氢化物的稳定性: YH3>MH3,所以D选项是正确的.所以C选项是正确的.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目