题目内容
【题目】现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子:阳离子H+、Na+、Al3+、Ag+、Ba2+;则离子OH-、Cl-、CO32-、NO3-、SO42-(各种离子不重复)。已知,①A、B两溶液呈碱性;C、D、E溶液呈酸性。②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。③D溶液与另外四种溶液反应都能产生沉淀。试回答下列问题:
(1)写由A与D的化学式:A___________D___________________。
(2)A与E溶液反应的离子方程式_________________________。
(3)已知:H+(aq)+OH-(aq)=H2O(l)△H=-akJ/mol,请写出相同条件下B与C的稀溶液反应的中和热的热化学方程式_________________________________。
(4)检验E溶液中阴离子的方法为__________________________。
(5)请写出向E溶液中加过量B溶液的化学方程式_____________________。
【答案】 Na2CO3 AgNO3 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ 1/2Ba(OH)2(aq)+HCl(aq)=1/2BaCl2(aq)+H2O(l) △H=-akJ·mol-1 取少量E溶液于试管中,先加HCl酸化,再滴加BaCl2溶液,若有白色沉淀产生,证明E溶液中含有SO42- Al2(SO4)3+4Ba(OH)2=3BaSO4↓+Ba(AlO2)2+4H2O
【解析】本题考查的离子推断。
根据题意告知A、B、C、D、E五种可溶性强电解质,并且A、B两溶液呈碱性,根据离子共存的知识判断。CO32-不能与H+、Al3+、Ag+、Ba2+共存,不满足题目要求中可溶性强电解质,所以CO32-只能与Na+结合成Na2CO3;OH-不能与H+、Al3+、Ag+结共存,只有与Ba2+结合形成Ba(OH)2,所以A、B应是Na2CO3、Ba(OH)2中的任一种。Ag+不能与Cl-、SO42-共存。所以只能与NO3-形成AgNO3。根据信息向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失,说明溶液中存在Al3+,所以得出B是Ba(OH)2,A是Na2CO3。沉淀又没完全消失,所以可推断出阴离子是SO42-,所以可推出E是Al2(SO4)3。剩下阳离子是H+,阴离子是Cl-,则C为HCl。根据D溶液与另外四种溶液反应都能产生沉淀可推断出D是AgNO3。综上所述可知A为Na2CO3、 B为Ba(OH)2、C为HCl、D为AgNO3、E为Al2(SO4)3。
解析:(1)由以上分析可知,A为Na2CO3,D为AgNO3;(2)Na2CO3与Al2(SO4)3在溶液中发生双水解反应,反应的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;(3)根据中和热的定义是酸与碱反应生成1molH2O所放出的热量,再把各物质状态分别标出得到:![]() Ba(OH)2
Ba(OH)2
(aq)+HCl(aq)=![]() BaCl2(aq)+H2O(l)△H=-akJ·mol-1;(4)E为Al2(SO4)3,阴离子为SO42—,检验SO42—的方法是取少量Al2(SO4)3溶液于试管中,先加HCl酸化,再滴加BaCl2溶液,若有白色沉淀产生,证明Al2(SO4)3溶液中含有SO42-;(5)Al2(SO4)3溶液中加入过量Ba(OH)2溶液生成硫酸钡沉淀、偏铝酸钡和水,反应的化学方程式为:Al2(SO4)3+4Ba(OH)2=3BaSO4↓
BaCl2(aq)+H2O(l)△H=-akJ·mol-1;(4)E为Al2(SO4)3,阴离子为SO42—,检验SO42—的方法是取少量Al2(SO4)3溶液于试管中,先加HCl酸化,再滴加BaCl2溶液,若有白色沉淀产生,证明Al2(SO4)3溶液中含有SO42-;(5)Al2(SO4)3溶液中加入过量Ba(OH)2溶液生成硫酸钡沉淀、偏铝酸钡和水,反应的化学方程式为:Al2(SO4)3+4Ba(OH)2=3BaSO4↓
+Ba(AlO2)2+4H2O。

 应用题作业本系列答案
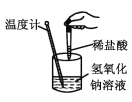
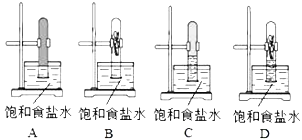
应用题作业本系列答案【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )
反应装置或图像 | 实验现象或图像信息 | |
A |
| 反应开始后,针筒活塞向右移动 |
B |
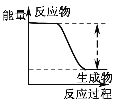
| 反应物总能量大于生成物总能量 |
C |
| 反应开始后,甲处液面低于乙处液面 |
D |
| 温度计的水银柱不断上升 |
A. AB. BC. CD. D
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和碘单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D