题目内容
(15分)某石油液化气由丙烷和丁烷组成,其质量分数分别为80%和20%。它们燃烧的热化学方程式分别为:
C3H8(g)+5O2(g)==3CO2(g)+4H2O(1) △H=-2 200kJ/mol
C4H10(g)+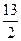 O2(g)==4CO2(g)+5H2O(1) △H=-2 900 kJ/mol
O2(g)==4CO2(g)+5H2O(1) △H=-2 900 kJ/mol
有一质量为0.80kg、容积为4.0L的铝壶,将一壶20℃的水烧开需消耗液化石油气0.056kg,试计算该燃料的利用率。[已知水的比热为4.2kJ/(kg·℃),铝的比热为0.88kJ/(kg·℃)]
C3H8(g)+5O2(g)==3CO2(g)+4H2O(1) △H=-2 200kJ/mol
C4H10(g)+
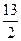 O2(g)==4CO2(g)+5H2O(1) △H=-2 900 kJ/mol
O2(g)==4CO2(g)+5H2O(1) △H=-2 900 kJ/mol有一质量为0.80kg、容积为4.0L的铝壶,将一壶20℃的水烧开需消耗液化石油气0.056kg,试计算该燃料的利用率。[已知水的比热为4.2kJ/(kg·℃),铝的比热为0.88kJ/(kg·℃)]


将水烧开所需热量为:Q=cm(t-t0)=(4.2×4.0+0.88×0.80)×(100-20)="1" 400(kJ)
所以,燃料的利用率为:
 ×100%=50%
×100%=50%略

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
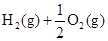 ══
══

 ══
══

 ══2CO2(g)+2H2O(l)
══2CO2(g)+2H2O(l)
 ══
══

 一是丁烷。在101 kPa时,10 kg丁烷(相对分子质量为58)完全燃烧生成CO2和液态H2O放出热量5×105 kJ,丁烷的燃烧热为___________,丁烷燃烧的热化学方程式为_________________________________________________。
一是丁烷。在101 kPa时,10 kg丁烷(相对分子质量为58)完全燃烧生成CO2和液态H2O放出热量5×105 kJ,丁烷的燃烧热为___________,丁烷燃烧的热化学方程式为_________________________________________________。 FeO(s) ?
FeO(s) ? 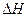 =-272.0KJ/mol
=-272.0KJ/mol 则 Al(s)的单质和FeO(s)反应的热化学方程式是_____________________________________。
则 Al(s)的单质和FeO(s)反应的热化学方程式是_____________________________________。 O2(g)= H2O(g);ΔH1=" a" kJ/mol
O2(g)= H2O(g);ΔH1=" a" kJ/mol 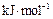
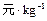
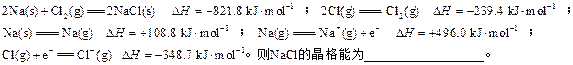
 稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( ) )+
)+ H2 SO4(aq)=K2SO4(aq)+H2O(l);ΔH=-57.3kJ/mol
H2 SO4(aq)=K2SO4(aq)+H2O(l);ΔH=-57.3kJ/mol