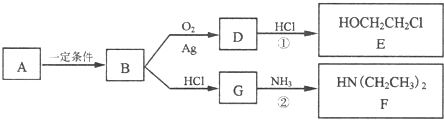
题目内容
【题目】(1)在标准状况下,将充满NO2的试管倒扣到盛水的水槽中,一段时间后,试管内气体的体积是试管体积的________________,假设试管内溶质不扩散,则试管内溶液中溶质的物质的量浓度为___________________。
(2)某铁的“氧化物”样品,用5mol/L的盐酸100mL恰好完全溶解,所得溶液还能吸收标准状况下1.12L氯气,使其中Fe2+恰好全部转化为Fe3+,发生反应的离子方程式为_________,该样品中Fe和O的个数比为_______________。
(3)向盛有10mL1mol/LNH4Al(SO4)2溶液的烧杯中滴加1mol/LNaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:(已知NH4++OH-=NH3·H2O)
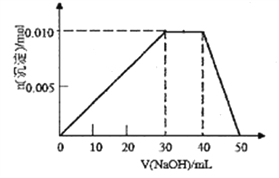
①写出滴加NaOH溶液40~50mL时反应的离子方程式:__________________。
②若10mL1mol/LNH4Al(SO4)2溶液中改加20mL1.15mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_________________mol。
【答案】 1/3 1/22.4mol/L或0.045mol/L 2Fe2++Cl2=2Fe3++2Cl- 4:5 Al(OH)3+OH-=AlO2-+2H2O 0.024
【解析】试题分析:(1)根据![]() 分析;根据
分析;根据![]() 计算试管内溶液中溶质的物质的量浓度;(2)Fe2+被氯气氧化为Fe3+,氯气被还有为Cl-;铁的“氧化物”中氧原子与盐酸中氢离子反应生成水,铁的“氧化物”中铁原子最终生成FeCl3,根据元素守恒计算Fe和O的个数比;(3)①滴加NaOH溶液40~50mL时沉淀溶解,是Al(OH)3与OH-反应生成AlO2- ;②10mL 1molL-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.15mol/L Ba(OH)2溶液中Ba2+物质的量为0.023mol,OH-为0.046mol,发生的反应有SO42-+Ba2+=BaSO4↓,根据图像可知OH-依次发生Al3++3OH-=Al(OH)3↓、 NH4++OH-=NH3H2O、 Al(OH)3+OH-=AlO2-+2H2O
计算试管内溶液中溶质的物质的量浓度;(2)Fe2+被氯气氧化为Fe3+,氯气被还有为Cl-;铁的“氧化物”中氧原子与盐酸中氢离子反应生成水,铁的“氧化物”中铁原子最终生成FeCl3,根据元素守恒计算Fe和O的个数比;(3)①滴加NaOH溶液40~50mL时沉淀溶解,是Al(OH)3与OH-反应生成AlO2- ;②10mL 1molL-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.15mol/L Ba(OH)2溶液中Ba2+物质的量为0.023mol,OH-为0.046mol,发生的反应有SO42-+Ba2+=BaSO4↓,根据图像可知OH-依次发生Al3++3OH-=Al(OH)3↓、 NH4++OH-=NH3H2O、 Al(OH)3+OH-=AlO2-+2H2O
解析:(1)根据![]() ,3体积的NO2与水反应后生成1体积的NO气体,所以试管内气体的体积是试管体积的
,3体积的NO2与水反应后生成1体积的NO气体,所以试管内气体的体积是试管体积的![]() ;设试管的体积是VL,则NO2的物质的量是
;设试管的体积是VL,则NO2的物质的量是![]() ,生成硝酸的物质的量是
,生成硝酸的物质的量是![]() ;试管中液体的体积是
;试管中液体的体积是![]() ,根据
,根据![]() ,试管内溶液中溶质的物质的量浓度是
,试管内溶液中溶质的物质的量浓度是 ;(2)Fe2+被氯气氧化为Fe3+,氯气被还有为Cl-,反应的离子方程式是2Fe2++Cl2=2Fe3++2Cl-;铁的“氧化物”中氧原子与盐酸中氢离子反应生成水,氢离子的物质的量是5mol/L×0.1L=0.5mol,所以氧原子的物质的量是0.25mol;铁的“氧化物”中铁原子最终生成FeCl3,氯元素的物质的量是
;(2)Fe2+被氯气氧化为Fe3+,氯气被还有为Cl-,反应的离子方程式是2Fe2++Cl2=2Fe3++2Cl-;铁的“氧化物”中氧原子与盐酸中氢离子反应生成水,氢离子的物质的量是5mol/L×0.1L=0.5mol,所以氧原子的物质的量是0.25mol;铁的“氧化物”中铁原子最终生成FeCl3,氯元素的物质的量是![]() ,所以铁原子的物质的量是0.2mol,根据元素守恒Fe和O的个数比0.2:0.25=4:5;(3)①滴加NaOH溶液40~50mL时沉淀溶解,是Al(OH)3与OH-反应生成AlO2- ,反应离子方程式是Al(OH)3+OH-=AlO2-+2H2O;②10mL 1molL-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.15 molL-1Ba(OH)2溶液中Ba2+物质的量为0.023mol,OH-为0.046mol,由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
,所以铁原子的物质的量是0.2mol,根据元素守恒Fe和O的个数比0.2:0.25=4:5;(3)①滴加NaOH溶液40~50mL时沉淀溶解,是Al(OH)3与OH-反应生成AlO2- ,反应离子方程式是Al(OH)3+OH-=AlO2-+2H2O;②10mL 1molL-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.15 molL-1Ba(OH)2溶液中Ba2+物质的量为0.023mol,OH-为0.046mol,由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,

反应剩余OH-为0.046mol-0.03mol=0.016mol,![]()
反应剩余OH-为0.016mol-0.01mol=0.006mol,

故得到Al(OH)3沉淀为0.01mol-0.006mol=0.004mol
则最终得到固体为0.02mol+0.004mol=0.024mol。

 阅读快车系列答案
阅读快车系列答案