题目内容
【题目】某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl﹣、SO42﹣中的几种离子.
a.取0.1mL该废水于管中,加入足量的Ba(N03)溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生.
b.另取10mL该废水于管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解.生成沉淀的物质的量随加入NaOH物质的量关系如图所示.
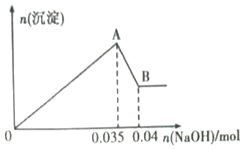
根据上述实验和图表数据:
(1)该废水中一定不含有的离子有______________(填离子符号).
(2)实验室配制100mL1molL﹣1的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要_____________(填仪器名称).
(3)写出A→B过程中发生反应的离子方程式:_________________________.
(4)该废水中,c(Al3+)=_______________________.
【答案】 Cu2+、Cl﹣ 100mL容量瓶、胶头滴管 Al(OH)3+OH﹣=AlO2﹣+H2O 0.5mol/L
【解析】无色溶液中不会存在有色的Cu2+;
a.取0.1mL该废水于管中,加入足量的Ba(NO3)溶液和稀硝酸,产生白色沉淀,该沉淀为硫酸钡,则原溶液中含有SO42﹣;充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生,说明原溶液中不存在Cl﹣;
b.另取10mL该废水于管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解,溶解的沉淀为氢氧化铝,不溶的沉淀为氢氧化镁,则原溶液中一定含有Mg2+、Al3+,
(1)根据分析可知,该废水中一定不含有的离子有:Cu2+、Cl﹣;
(2)实验室配制一定浓度的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,配制100mL溶液必须选用规格为100mL的容量瓶,定容时必须使用胶头滴管;
(3)A→B过程为沉淀溶解的过程,氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH﹣=AlO2﹣+H2O;
(4)根据反应Al(OH)3+OH﹣=AlO2﹣+H2O可知,n[Al(OH)3]=n(NaOH)=0.04mol-0.035mol=0.005mol,根据质量守恒可知原溶液中铝离子的物质的量为0.005mol,则原溶液中铝离子的浓度为:c(Al3+)=![]() =0.5mol/L。
=0.5mol/L。

 每课必练系列答案
每课必练系列答案【题目】一同学用某种粗盐进行提纯实验,步骤见下图.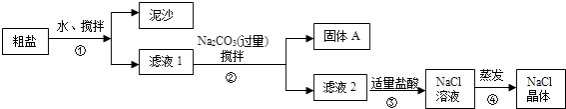
请回答:
(1)步骤①和②的操作名称是 .
(2)步骤③判断加入盐酸“适量”的方法是;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止 , 当蒸发皿中有较多量固体出现时,应 , 用余热使水分蒸干.
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 |
| 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含 | 取少量固体A于试管中,先滴入 , 再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, |
| 猜想Ⅲ成立 |