题目内容
在一定温度下,在固定容积的密闭容器中,可逆反应H2(g)+ Br2(g)  2HBr(g)达到平衡的标志是
2HBr(g)达到平衡的标志是
 2HBr(g)达到平衡的标志是
2HBr(g)达到平衡的标志是| A.断裂1 mol H-H键的同时生成2 mol H-Br键 |
| B.单位时间内消耗1 mol H2,同时生成1 mol Br2 |
| C.H2、Br2、HBr的分子数之比为1∶1∶2 |
| D.混合气体的压强不再改变 |
B
试题分析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此可以判断。A、根据反应式可知断裂1 mol H-H键的同时一定生成2 mol H-Br键,即二者的反应速率方向一致,因此不能说明反应达到平衡状态,A不正确;B、单位时间内消耗1 mol H2,则必然同时消耗1mol单质溴,由于同时生成1 mol Br2,所以单质溴的正逆反应速率相等,可以说明反应达到平衡状态,B正确;C、平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此H2、Br2、HBr的分子数之比为1∶1∶2不一定是平衡状态,C不正确;D、反应前后体积不变,因此压强始终是不变的,所以压强不变,不能说明反应达到平衡状态,D不正确,答案选B。

练习册系列答案
相关题目
 XC(g)+D(S),向家中通入6molA和2molB,向乙中通入1.5molA、0.5molB、3molC和2molD,反应一段时间后都达到平衡,此时测的甲、乙两个容器中的C的体积分数都是0.2,下列叙述中正确的是:
XC(g)+D(S),向家中通入6molA和2molB,向乙中通入1.5molA、0.5molB、3molC和2molD,反应一段时间后都达到平衡,此时测的甲、乙两个容器中的C的体积分数都是0.2,下列叙述中正确的是: CO2(g)+ H2(g) 达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后CO2的物质的量为
CO2(g)+ H2(g) 达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后CO2的物质的量为 pC(g)+qD(g);△H<0.下列结论中不正确的是
pC(g)+qD(g);△H<0.下列结论中不正确的是 2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )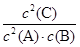
 2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是( )
2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是( ) 2Z(g)这是可逆反应,已知X2,Y2,Z的起始浓度分别为0.1摩尔/升,0.3摩尔/升,0.2摩尔/升,在一定条件下当反应达到平衡时,各物质浓度有可能是
2Z(g)这是可逆反应,已知X2,Y2,Z的起始浓度分别为0.1摩尔/升,0.3摩尔/升,0.2摩尔/升,在一定条件下当反应达到平衡时,各物质浓度有可能是