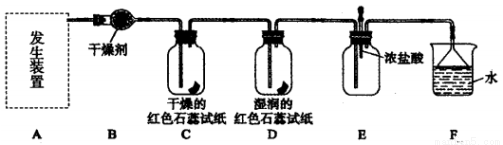
题目内容
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)已知:① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式 。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)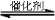 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如下左图:

①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。
②某温度下,将2.0 mol CO2(g)和6.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是 。

A. P3>P2,T3>T2 B. P1>P3,T1>T3
C. P2>P4,T4>T2 D. P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的平衡常数的表达式为:
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下CO的平衡转化率为 。
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案下列实验操作、现象与所得结论一致的是
实验操作 | 现象 | 结论 | |
A | 向盛有25mL 沸水的烧杯中滴入5~6滴FeCl3饱和溶液,继续煮沸。 | 溶液生成红褐色沉淀 | 制得Fe(OH)3胶体 |
B | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液。 | 前者溶液变蓝,后者有黄色沉淀。 | KI3溶液中存在平衡:I3- |
C | 将溴乙烷和NaOH乙醇溶液混合加热,产生气体通入酸性KMnO4溶液中。 | 酸性KMnO4溶液褪色。 | 一定产生了乙烯。 |
D | 在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液。 | 溶液褪色。 | CaCl2溶液有酸性。 |


 +yB(g)
+yB(g) zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )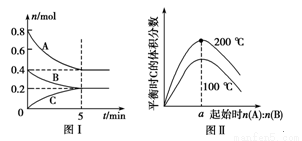
 的平均速率v(B)=0.02 mol·L-1·min-1
的平均速率v(B)=0.02 mol·L-1·min-1 料制备高纯氧化铁(软磁a-Fe2O3)的生产流程示意图:
料制备高纯氧化铁(软磁a-Fe2O3)的生产流程示意图: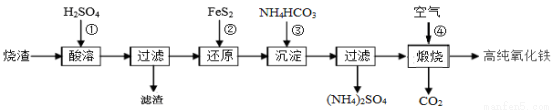
 I2+I-
I2+I- CH3OCH3(g)+3H2O(g),一定条件下,现有两个体积均为1.0L恒容密闭容器甲和乙,在甲中充入0.1molCO2和0.2molH2,在乙中充入0.2molCO2和0.4molH2,发生上述反应并达到平衡。该反应中CO2的平衡转化率随温度的变化曲线如图所示。下列说法正确的是
CH3OCH3(g)+3H2O(g),一定条件下,现有两个体积均为1.0L恒容密闭容器甲和乙,在甲中充入0.1molCO2和0.2molH2,在乙中充入0.2molCO2和0.4molH2,发生上述反应并达到平衡。该反应中CO2的平衡转化率随温度的变化曲线如图所示。下列说法正确的是
 示乙容器CO2的平衡转化率随温度变化的是曲线B
示乙容器CO2的平衡转化率随温度变化的是曲线B H2(g)+CO2(g) △H﹤0,在其他条件不变的情况下,下列说法正确的是
H2(g)+CO2(g) △H﹤0,在其他条件不变的情况下,下列说法正确的是 积),平衡不发生移动,反应放出的热量不变
积),平衡不发生移动,反应放出的热量不变 CaCl2+2NH3↑+2H2O]
CaCl2+2NH3↑+2H2O]