��Ŀ����
���ݻ�Ϊ2 L�ĺ����ܱ������з�����ӦxA(g) ��yB(g)
��yB(g) zC(g)��ͼ���ʾ200 ��ʱ������A��B��C���ʵ�����ʱ��ı仯��ͼ���ʾ��ͬ�¶���ƽ��ʱC�������������ʼn(A)��n(B)�ı仯��ϵ�������н�����ȷ���� ( )
zC(g)��ͼ���ʾ200 ��ʱ������A��B��C���ʵ�����ʱ��ı仯��ͼ���ʾ��ͬ�¶���ƽ��ʱC�������������ʼn(A)��n(B)�ı仯��ϵ�������н�����ȷ���� ( )
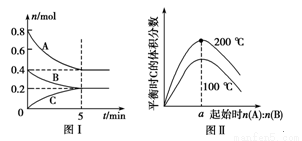
A��ͼ����֪��ӦxA(g)��yB(g) zC(g)�Ħ�H��0����a��2
zC(g)�Ħ�H��0����a��2
B��200 ��ʱ����Ӧ�ӿ�ʼ��ƽ�� ��ƽ������v(B)��0.02 mol��L��1��min��1
��ƽ������v(B)��0.02 mol��L��1��min��1
C������ͼ ����ʾ��ƽ��״̬�£�������ϵ�г���He��˲�䣬v����v��
����ʾ��ƽ��״̬�£�������ϵ�г���He��˲�䣬v����v��
D��200 ��ʱ���������г���2 mol A��1 mol B���ﵽƽ��ʱ��A�������������0.5
 ��У����ϵ�д�
��У����ϵ�д����и���ʵ��������������ó��Ľ��۲���ȷ����( )
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ��ij��Һ�м��������ữ��BaCl2��Һ | ���ɰ�ɫ���� | ����Һ�в�һ������SO42�� |
B | FeCl2��Һ�У��μ�KSCN��Һ����ˮ | �μ�KSCN��Һ�������Ա仯���μ���ˮ����Һ��� | �����ԣ�Br2��Fe3+ |
C | ȡ���õ�Na2O2��ĩ�������еμӹ��������� | ������ɫ���� | Na2O2û�б��� |
D | ��һƬ�������ھƾ������������� | �����ۻ��������� | ��������������Al2O3��Ĥ����Al2O3�۵����Al |
����̼ѭ������������ĸ߶����ӣ�����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӡ����ԡ���̼���á�����Ϊ��ѧ���о�����Ҫ���⡣
(1)��֪���� CO(g)+H2O(g) H2(g)+CO2(g) ��H����41 kJ��mol��1
H2(g)+CO2(g) ��H����41 kJ��mol��1
�� C(s)+2H2(g) CH4(g) ��H����73 kJ��mol��1
CH4(g) ��H����73 kJ��mol��1
�� 2CO(g) C(s)+CO2(g) ��H����171 kJ��mol��1
C(s)+CO2(g) ��H����171 kJ��mol��1
д��CO2��H2��Ӧ����CH4��H2O(g)���Ȼ�ѧ����ʽ ��
(2)��ȼú�����е�CO2ת��Ϊ�����ѵķ�Ӧԭ��Ϊ��
2CO2(g)+6H2(g)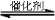 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
��֪һ�������£��÷�Ӧ��CO2��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2)/n(CO2)]�ı仯����������ͼ��

����������������ʱ��������ͼ�л���ƽ��ʱCH3OCH3�����������Ͷ�ϱ�[n(H2)/n(CO2)]�仯������ͼ��
��ij�¶��£���2.0 mol CO2(g)��6.0 mol H2(g)�����ݻ�Ϊ2L���ܱ������У���Ӧ����ƽ��ʱ���ı�ѹǿ���¶ȣ�ƽ����ϵ��CH3OCH3(g)�����ʵ��������仯�������ͼ��ʾ�������¶Ⱥ�ѹǿ�Ĺ�ϵ�ж���ȷ���� ��

A. P3>P2��T3>T2 B. P1>P3��T1>T3
C. P2>P4��T4>T2 D. P1>P4��T2>T3
(3)ú����ͨ��ͨ���о���ͬ�¶���ƽ�ⳣ���Խ������ʵ�����⡣��֪�������CO��ˮ�������뷴Ӧ��ʱ���ᷢ�����·�Ӧ��CO(g)+H2O(g) H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��
H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
�÷�Ӧ��ƽ�ⳣ���ı���ʽΪ��
�÷�Ӧ������Ӧ������ ��Ӧ(����ȡ����ȡ�)������500��ʱ���У�����ʼʱCO��H2O��Ũ�Ⱦ�Ϊ0.020 mol��L-1���ڸ�������CO��ƽ��ת����Ϊ ��



 O2(g) ��H����266 kJ��mol��1
O2(g) ��H����266 kJ��mol��1
 CaO��s��+CO��g��+CO2��g������ǰ5min������CaO������Ϊ16.8g����ö�ʱ���ڦԣ�CO��=__________mol��L��1��s��1������Ӧ�ﵽƽ����������ѹ����ԭ����һ�룬������˵����ȷ����__________�����ѡ���ţ���
CaO��s��+CO��g��+CO2��g������ǰ5min������CaO������Ϊ16.8g����ö�ʱ���ڦԣ�CO��=__________mol��L��1��s��1������Ӧ�ﵽƽ����������ѹ����ԭ����һ�룬������˵����ȷ����__________�����ѡ���ţ���