题目内容
高纯氧化铁是现代电子工业的重要材料。以下是用硫酸厂产生的烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原 料制备高纯氧化铁(软磁a-Fe2O3)的生产流程示意图:
料制备高纯氧化铁(软磁a-Fe2O3)的生产流程示意图:
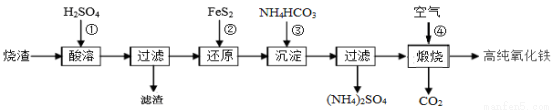
(1)酸浸时,常需将烧渣粉碎、并加入过量H2SO4,其目的是 ;
滤渣的主要成分为 (填化学式)。
(2)加入FeS2时,发生反应②的离子方程式为 。
(3)加入NH4HCO3目的是 。“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是 。检验FeCO3是否洗涤干净的方法是 。
(4)煅烧时,发生反应④的化学方程式为 。
 小学能力测试卷系列答案
小学能力测试卷系列答案下列根据实验操作和现象所得出的结论不正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 该溶液中不一定含有SO42﹣ |
B | FeCl2溶液中,滴加KSCN溶液和溴水 | 滴加KSCN溶液,无明显变化;滴加溴水后,溶液变红 | 氧化性:Br2>Fe3+ |
C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
D | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)已知:① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式 。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)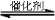 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如下左图:

①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。
②某温度下,将2.0 mol CO2(g)和6.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是 。

A. P3>P2,T3>T2 B. P1>P3,T1>T3
C. P2>P4,T4>T2 D. P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的平衡常数的表达式为:
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下CO的平衡转化率为 。



 CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为16.8g,则该段时间内υ(CO)=__________mol·L-1·s-1;当反应达到平衡后,将容器体积压缩到原来的一半,则下列说法正确的是__________(填答案选项编号)。
CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为16.8g,则该段时间内υ(CO)=__________mol·L-1·s-1;当反应达到平衡后,将容器体积压缩到原来的一半,则下列说法正确的是__________(填答案选项编号)。
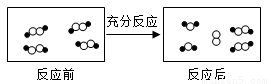
 氧化铝具有弱碱性,可用作净水剂
氧化铝具有弱碱性,可用作净水剂 和○代表不同元素的原子。
和○代表不同元素的原子。