题目内容
【题目】氧化亚铜是大型水面舰艇防护涂层的重要原料.某小组通过查阅资料,进行如下研究. 
已知 ![]() 碱性条件下氧化为
碱性条件下氧化为 ![]() .
.
Ⅰ:Cu2O的制取
(1)可以用葡萄糖还原法制Cu2O,是因为葡萄糖分子中含有(填官能团名称).
(2)实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯外,还需要 .
Ⅱ:检验样品中是否含有CuO
方案1:将制得的Cu2O样品溶于足量稀硫酸.
(3)甲同学认为若溶液变为蓝色,则说明样品中含有CuO杂质.乙同学认为此推论不合理,用化学用语解释原因 .
(4)甲同学通过反思,认为将定性检验改为定量测定便能确定样品中是否含有CuO杂质,应测量的数据是 .
方案2:丙同学认为采用如下装置(所加药品均足量)进行实验,通过测定c装置反应后固体的质量以及d装置反应前后增重的质量,可计算,从而确定样品中是否含有氧化铜.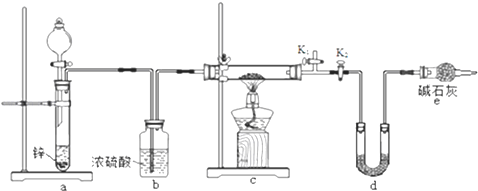
(5)装置a中所加的酸是(填化学式),装置e中碱石灰的作用是 .
(6)点燃装置c中酒精灯之前需进行的操作是 .
(7)熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是 .
【答案】
(1)醛基
(2)漏斗、玻璃棒
(3)Cu2O+H2SO4=CuSO4+Cu+H2O
(4)Cu2O样品的质量、反应后剩余固体(Cu)的质量
(5)H2SO4;防止空气中的水进入d装置,m(H2O)测定不准确
(6)打开K1 , 关闭K2 , 通一段时间氢气后验纯,打开K2 , 关闭K1
(7)防止生成的Cu单质在高温下又被氧气氧化为CuO,导致测定数据不准确
【解析】Ⅰ、(1)葡萄糖是多羟基醛,其中醛基能将氢氧化铜还原成氧化亚铜,所以可以用葡萄糖还原法制Cu2O,所以答案是:醛基;(2)新制氢氧化铜氧化乙醛实验需要加热,故所需玻璃仪器为试管、酒精灯,分离生成的氧化亚铜沉淀,需要进行过滤操作,所需玻璃仪器为漏斗、玻璃棒、烧杯,所以答案是:漏斗、玻璃棒;Ⅱ、(3)氧化亚铜也和硫酸发生氧化还原反应生成硫酸铜溶液显蓝色,反应的化学方程式为:Cu2O+H2SO4=CuSO4+Cu+H2O;所以答案是:Cu2O+H2SO4=CuSO4+Cu+H2O;(4)将定性检验改为定量测定便能确定样品中是否含有CuO杂质,应测量的数据是Cu2O样品的质量、反应后剩余固体(Cu)的质量;所以答案是:Cu2O样品的质量、反应后剩余固体(Cu)的质量;(5)d装置中的碱石灰会吸收水和酸性气体,防止a中酸挥发,故选难挥发性酸硫酸,装置e中碱石灰的作用是防止空气中的水进入d装置,m(H2O)测定不准确;所以答案是:H2SO4;防止空气中的水进入d装置,m(H2O)测定不准确;(6)打开K1 , 关闭K2 , 通一段时间氢气后验纯,验纯后应保持气体能通过d装置,使生成的水全部被d装置吸收,所以答案是:打开K2 , 关闭K1;所以答案是:打开K1 , 关闭K2 , 通一段时间氢气后验纯,打开K2 , 关闭K1;(7)灼热的铜和氧气会发生反应生成氧化铜,所以熄灭酒精灯之后,仍需通一段时间H2至试管冷却是防止空气进入氧化生成的铜,测定结果产生误差;
所以答案是:防止生成的Cu单质在高温下又被氧气氧化为CuO,导致测定数据不准确.

 名校课堂系列答案
名校课堂系列答案【题目】如图所示的过程是目前直接利用太阳能的研究热点.人们把通过人工光化学手段合成燃料的过程叫做人工光合作用. 
(1)在上图构想的物质和能量循环中太阳能最终转化为能.
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH,该反应的化学方程式为:2CO2(g)+4H2O(g) ![]() 2CH3OH(g)+3O2(g). 一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如下表所示:
2CH3OH(g)+3O2(g). 一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如下表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
①用CH3OH表示0~3min内该反应的平均反应速率为 .
②能说明该反应已达到平衡状态的是 .
a.v正(H2O)=2v逆(CO2)
b.n(CH3OH):n(O2)=2:3
c.容器内密度保持不变
d.容器内压强保持不变
(3)用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的极(填“正”或“负”),通入氧气的一极的电极反应式为 .