题目内容
有A、B、C、D同周期的四种元素,其原子序数依次增大,且质子数均小于18。A元素原子的最外层只有1个电子,该元素阳离子与N3-核外电子排布相同;B元素原子核外各轨道上均无成单电子;C元素原子的价电子排布为ns2np1;D-的核外电子构型与Ar相同。
(1)写出A、C、D的元素名称:A________,C________,D________。
(2)写出B元素原子的电子排布式__________________________________________。
D元素原子的电子排布图_________________________________________________。
(3)A、B、C、D电负性由小到大的顺序为(填元素符号)_____ ___。
(1)写出A、C、D的元素名称:A________,C________,D________。
(2)写出B元素原子的电子排布式__________________________________________。
D元素原子的电子排布图_________________________________________________。
(3)A、B、C、D电负性由小到大的顺序为(填元素符号)_____ ___。
(1)钠、铝、氯 (2)1s22s22p63s2
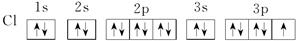
(3)Na<Mg<Al<Cl

(3)Na<Mg<Al<Cl
A元素原子的最外层只有1个电子,且该元素阳离子与N3-核外电子排布相同,所以A是钠元素。B元素原子核外各轨道上均无成单电子,原子序数大于钠的,所以B是镁元素。C元素原子的价电子排布为ns2np1,所以C是铝元素。D-的核外电子构型与Ar相同,则D是氯元素。非金属性越强,电负性越大,所以电负性大小顺序是Na<Mg<Al<Cl。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 结合形成的化合物的化学式是( )
结合形成的化合物的化学式是( )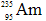 ,它和
,它和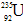 比较,下列叙述中不正确的是( )
比较,下列叙述中不正确的是( )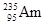 比
比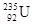 少3个中子
少3个中子