题目内容
15g铁粉和氧化铁的混合物,放入150mL稀H2SO4中,发现固体完全溶解,并放出1.68L H2(标准状况),加入KSCN溶液后,无颜色变化。为了使Fe2+完全转化为Fe(OH)2沉淀,共耗用200mL 3 mol/L NaOH溶液,则原硫酸溶液的物质的量浓度为
| A.4 mol·L—1 | B.3 mol·L—1 | C.2 mol·L—1 | D.1 mol·L—1 |
C
试题分析:当溶液中的亚铁离子全部转化为沉淀时,留在溶液中的就只有硫酸钠,则根据氢氧化钠的物质的量是0.2L×3mol/L=0.6mol并结合钠离子守恒可知,生成硫酸钠的物质的量是0.6mol÷2=0.3mol。因此根据S原子守恒可知,原硫酸的物质的量是0.3mol,则浓度=0.3mol÷0.15L=2mol/L,答案选C。

练习册系列答案
相关题目
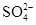 生成,可向溶液中滴加Ba(NO3)2溶液
生成,可向溶液中滴加Ba(NO3)2溶液 样品含有少量
样品含有少量 杂质。现要测定其中
杂质。现要测定其中 的质量分数,实验按以下步骤进行:
的质量分数,实验按以下步骤进行:

 溶液18.00mL。该样品中
溶液18.00mL。该样品中
 Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。