题目内容
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32﹣、SO42﹣、SiO32﹣、NO3﹣中的一种或几种离子,取该溶液进行实验,其现象及转化如下图.反应过程中有一种气体是红棕色. 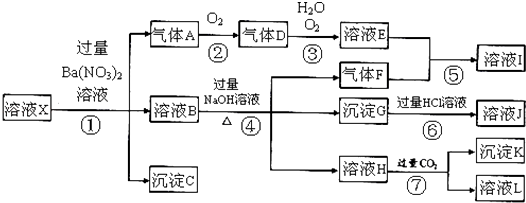
请回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有:
(2)溶液X中,关于NO3ˉ的判断一定正确的是;a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为;
(4)转化⑥发生反应的现象为;
(5)转化④中产生H的离子方程式为;
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为;
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 .
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMnO4溶液,⑥氯水和KSCN的混合溶液.
【答案】
(1)CO32﹣、SiO32﹣
(2)b
(3)3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O
(4)红褐色沉淀逐渐溶解,溶液变为黄色
(5)Al3++4OH﹣=AlO2﹣+2H2O
(6)4:1
(7)②
【解析】解:某强酸性溶液X,则溶液中不存在弱酸根离子CO32﹣、SiO32﹣ , 溶液和硝酸钡溶液反应生成沉淀C,则溶液呈存在SO42﹣ , 不存在和硫酸根离子反应的Ba2+ , C是BaSO4;酸性条件下硝酸根离子具有强氧化性,所以溶液中Fe2+和NO3﹣不能共存,加入硝酸钡产生气体,则溶液中存在Fe2+ , 不存在NO3﹣ , A是NO;
溶液B中加入氢氧化钠溶液时,产生气体F,则溶液中含有NH4+ , F是NH3 , 产生沉淀,则溶液中存在Fe3+ , 沉淀G是Fe(OH)3 , 氢氧化铁和盐酸反应生成FeCl3 , 则J是FeCl3 , 溶液H中通入过量二氧化碳生成沉淀,则溶液中存在Al3+ , 沉淀K是Al(OH)3 , 溶液L是NaHCO3;
A是NO,则D是NO2 , 二氧化氮化和水反应生成硝酸和NO,则E是HNO3 , 硝酸和氨气反应生成硝酸铵,则I是NH4NO 3 . (1)由强酸性条件即可判断溶液X中一定不存在弱酸根离子,所以不存在的离子有CO32﹣、SiO32﹣ , 所以答案是:CO32﹣、SiO32﹣;(2)强酸性溶液中硝酸根离子具有强氧化性,如果存在硝酸根离子,则不存在亚铁离子,加入硝酸钡溶液时不能产生气体,所以溶液X中一定没有NO3﹣ , 故选b;(3)亚铁离子和硝酸反应生成铁离子、一氧化氮和水,离子反应方程式为:3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O,所以答案是:3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O;(4)氢氧化铁和稀盐酸反应生成氯化铁和水,氢氧化铁为红褐色沉淀,氯化铁溶液呈黄色,所以看到的现象是:红褐色沉淀逐渐溶解,溶液变为黄色,所以答案是:红褐色沉淀逐渐溶解,溶液变为黄色;(5)铝离子和过量氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为:Al3++4OH﹣=AlO2﹣+2H2O,所以答案是:Al3++4OH﹣=AlO2﹣+2H2O;(6)若转化③中,NO2、H2O、O2三种物质恰好发生化合反应生成HNO3 , 该反应方程式为:4NO2+2H2O+O2=4HNO3 , 则反应中D与O2的物质的量之比为4:1,所以答案是:4:1;(7)溶液中铁离子是否存在不能确定,铁离子和硫氰化钾溶液反应生成血红色溶液,所以可以用硫氰化钾溶液检验,故选②.

 名校课堂系列答案
名校课堂系列答案