题目内容
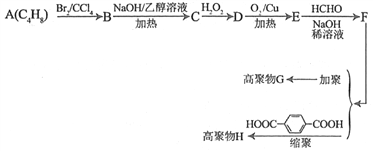
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
(4)硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2=S4O62-+2I-
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置)
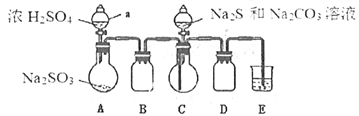
实验步骤:
(1)按如图所示组装好装置后,应先_______________(填操作名称),再按图示加入试剂。仪器B和D的作用是____________________________;E中的试剂是__________(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向烧瓶C中加入Na2S和Na2CO3混合溶液,再向烧瓶A中滴加浓H2SO4。C中反应生成Na2S2O3和CO2,化学方程式为______________________。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经蒸发、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
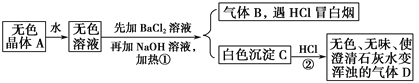
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择):
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)用I2的标准溶液测定产品的纯度
取10.0g产品,配制成100mL溶液,配制溶液的蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除__________及二氧化碳。取10.00mL溶液。以________溶液为指示剂,用浓度为0.10mol/LI2的标准溶波进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
滴定时,达到滴定终点的现象是___________________________________________。Na2S2O3·5H2O在产品中的质量分数是_______________(用百分数表示,且保留1位小数)。
【答案】 检查装置的气密性 安全瓶(或防止倒吸) B 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 过滤、蒸馏水洗涤沉淀,再向沉淀中加入足量的稀盐酸 水中溶解的氧气 淀粉 当加入最后一滴碘水时,溶液无色变蓝色,并且半分钟内不褪色 99.2%
【解析】试题分析:(1).涉及气体的实验,要先验证装置气密性;SO2易溶于水,实验中要防止倒吸;SO2是酸性氧化物,能与碱性溶液反应;(2)C中SO2与Na2CO3和Na2S反应生成Na2S2O3和CO2;Ⅲ.(1)根据Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl分析;(2)蒸馏水经过煮沸可以除去水中溶解的氧气;用碘液进行滴定,所以用淀粉作指示剂;当加入最后一滴碘水时,溶液无色变蓝色,并且半分钟内不褪色时,达到滴定终点。根据方程式2Na2S2O3+I2= Na2S4O6+2NaI进行计算。
解析:(1).涉及气体的实验,要先验证装置气密性,所以组装好装置后,应先检查装置的气密性,再按图示加入试剂;SO2易溶于水,实验中要防止倒吸,B和D的作用是防倒吸;SO2是酸性氧化物,能与碱性溶液反应,所以E中的试剂是氢氧化钠溶液,选B;(2)C中SO2与Na2CO3和Na2S反应生成Na2S2O3和CO2,反应方程式是2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2;Ⅲ.(1)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl,所以取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤、蒸馏水洗涤沉淀,再向沉淀中加入足量的稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4;(2)蒸馏水经过煮沸可以除去水中溶解的氧气;用碘液进行滴定,所以用淀粉作指示剂;当加入最后一滴碘水时,溶液无色变蓝色,并且半分钟内不褪色时,达到滴定终点。设10mL溶液中含Na2S2O3·5H2O xg,第二次实验数值偏离正常值舍去,第一次、第三次实验消耗碘液的平均体积为20mL,

X=0.992g;100mL溶液中含Na2S2O3·5H2O 9.92g,则Na2S2O3·5H2O在产品中的质量分数是![]() 。
。