题目内容
【题目】某淡黄色粉末可在潜水艇中作为氧气的来源,常被用作供氧剂。根据下图所示转化关系及现象填空:
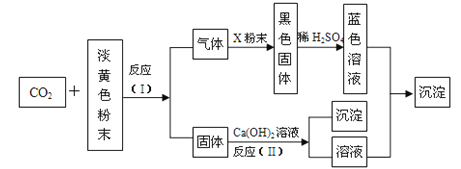
(1)该淡黄色粉末为__________________;
(2)X粉末的名称为__________________;
(3)反应(I)的化学方程式为______________________________;
(4)反应(II)的化学方程式为____________________________。
【答案】 Na2O2或过氧化钠 铜 2Na2O2+2CO2=2Na2CO3+O2 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
【解析】淡黄色粉末为Na2O2,生成气体为氧气,固体为碳酸钠,由氧气和X反应的产物以及与硫酸反应后的溶液的颜色可知X为Cu,反应Ⅱ为碳酸钠与氢氧化钙的反应,生成沉淀为碳酸钙,溶液为氢氧化钠溶液,则氢氧化钠与硫酸铜反应生成氢氧化铜沉淀。
(1)根据上述分析可知淡黄色粉末为Na2O2或过氧化钠,故答案为:Na2O2或过氧化钠;
(2)X粉末为铜,故答案为:铜;
(3)反应(I)为过氧化钠与二氧化碳的反应,生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(4)反应Ⅱ为碳酸钠与氢氧化钙的反应,生成碳酸钙和氢氧化钠,反应的化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。

【题目】(选修三——物质结构与性质)氮和磷元素的单质和化合物在农药生产及工业制造业等领域用途非常广泛,请根据提示回答下列问题:
(l)科学家合成了一种阳离子为“N5n+”、其结构是对称的,5个N排成“V”形,每个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式分“N8”的离子晶体,其电子式为__________________,其中的阴离子的空间构型为_________。
(2)2001年德国专家从硫酸钱中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子的形式存在。N4H44+根系易吸收,但它遇到碱时会生成类似白磷的N4分子,不能被植物吸收。1个N4H44+中含有______个σ键。
(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因_________________________。
(4)P4S3可用于制造火柴,其分子结构如图l所示。

①P4S3分子中硫原子的杂化轨道类型为_______。
②每个P4S3分子中含孤电子对的数月为_______。
(5)某种磁性氮化铁的晶胞结构如图2所示,该化合物的化学式为______。若晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为_______g/㎝3(用含a c和NA的式子表示)

(6)高温超导材料,是具有高临界转变温度(Te)能在液氮温度度条件下工作的超导材料。高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为[Ar]______;化合物中,稀土元素最常见的化合价是+3 ,但也有少数的稀土元素可以显示+4价,观察下面四种稀土元素的电离能数据,判断最有可能显示+4价的稀土元素是_____________。
几种稀土元素的电离能(单位:KJ/mol)
元素 | I1 | I2 | I3 | I4 |
Se(钪) | 633 | 1235 | 2389 | 7019 |
Y(铱) | 616 | 1181 | 1980 | 5963 |
La(镧) | 538 | 1067 | 1850 | 4819 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |