题目内容
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20.00mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:
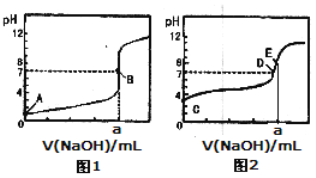
以HA表示酸,下列说法正确的是
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
【答案】B
【解析】
试题分析:因为滴定终点时NaCl溶液为中性,CH3COONa溶液为碱性,故滴定盐酸的曲线是图1,A错,相同的NaOH中和相同的酸C错;达到B、D状态时的pH=7,c(H+)=c(OH—),根据溶液的电荷守恒,c(Na+)=c(A—),B正确;在醋酸溶液中滴定NaOH,pH=7时,0mL< V(NaOH)<20.00mL,但有:c(A-)=c(Na+)>c(H+)=c(OH-),D不正确。

练习册系列答案
相关题目
【题目】金属钠既能跟氧气、水等无机物反应,也能跟酒精、醋酸等有机物反应。要研究金属钠跟酒精的反应以及它与水反应的异同点,下列研究方法中没有用到的是
A. 实验法 B. 观察法 C. 分类法 D. 比较法