题目内容
常温时,将V1mL c1 mol/L的氨水滴加到 V2mL c2 mol/L 的盐酸中,则
小题1:若混合溶液的pH=7,则 c1V1 c2V2; c(NH4+) c(Cl-)(填>、=或<,下同)
小题2:若混合溶液的pH>7,则c1V1 c2V2; c(NH4+) c(Cl-)
小题3:若V1=V2、c1= c2,则混合溶液中离子浓度的大小关系为 。若此时溶液的pH=a,则由水电离出来的H+的浓度_________ mol·L-1,并写出下列算式的数学表达式: c(Cl-)—c(NH4+)=________________ mol·L-1
小题4:若V1=V2,且混合溶液的pH<7,则一定有c1< c2吗?请说明理由 。
小题1:若混合溶液的pH=7,则 c1V1 c2V2; c(NH4+) c(Cl-)(填>、=或<,下同)
小题2:若混合溶液的pH>7,则c1V1 c2V2; c(NH4+) c(Cl-)
小题3:若V1=V2、c1= c2,则混合溶液中离子浓度的大小关系为 。若此时溶液的pH=a,则由水电离出来的H+的浓度_________ mol·L-1,并写出下列算式的数学表达式: c(Cl-)—c(NH4+)=________________ mol·L-1
小题4:若V1=V2,且混合溶液的pH<7,则一定有c1< c2吗?请说明理由 。
小题1: > =
小题2: > >
小题3:c(Cl-)>c(NH4+)>c(H+)>c(OH-) ;10-a ; 10-a-10a-14
小题4:不一定,c1= c2时,两者恰好反应生成NH4Cl溶液,pH<7,c1>c2时,pH也可能小于7。
考查酸碱中和的有关计算以及溶液中离子浓度大小关系的比较。
小题1:氨水是弱碱,若氨水和盐酸恰好反应,生成物氯化铵水解,溶液显酸性。若溶液显中性,则说明氨水过量,即c1V1>c2V2。根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知,当溶液显中性 即c(H+)=c(OH-)时,c(NH4+)=c(Cl-)。
小题2:若混合溶液的pH>7,则氨水仍然是过量的,即c1V1>c2V2。根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知,此时c(NH4+)>c(Cl-)。
小题3:若V1=V2、c1= c2,则二者恰好反应,溶液中只有氯化铵,则混合溶液中离子浓度的大小关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-)。NH4+结合水电离出的OH-,促进水的电离,所以溶液中的氢离子就是水电离出的氢离子,即浓度为10-a mol/L。根据电荷守恒可知c(Cl-)-c(NH4+)=c(H+)-c(OH-)=10-a-10a-14 mol/L。
小题4:溶液显酸性,有可能水盐酸过量,也有可能水生成的氯化铵水解导致的。即使氨水过量,如果氯化铵的水解程度大于氨水的电离程度,溶液仍然会显酸性。例如:当c1= c2时,两者恰好反应生成NH4Cl溶液,pH<7。
小题1:氨水是弱碱,若氨水和盐酸恰好反应,生成物氯化铵水解,溶液显酸性。若溶液显中性,则说明氨水过量,即c1V1>c2V2。根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知,当溶液显中性 即c(H+)=c(OH-)时,c(NH4+)=c(Cl-)。
小题2:若混合溶液的pH>7,则氨水仍然是过量的,即c1V1>c2V2。根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知,此时c(NH4+)>c(Cl-)。
小题3:若V1=V2、c1= c2,则二者恰好反应,溶液中只有氯化铵,则混合溶液中离子浓度的大小关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-)。NH4+结合水电离出的OH-,促进水的电离,所以溶液中的氢离子就是水电离出的氢离子,即浓度为10-a mol/L。根据电荷守恒可知c(Cl-)-c(NH4+)=c(H+)-c(OH-)=10-a-10a-14 mol/L。
小题4:溶液显酸性,有可能水盐酸过量,也有可能水生成的氯化铵水解导致的。即使氨水过量,如果氯化铵的水解程度大于氨水的电离程度,溶液仍然会显酸性。例如:当c1= c2时,两者恰好反应生成NH4Cl溶液,pH<7。

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
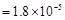 ,Ka(HSCN)
,Ka(HSCN)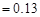 。在物质的量浓度均为
。在物质的量浓度均为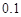 mol·L
mol·L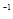 的CH3COONa和NaSCN混合溶液中,下列排序正确的是( )
的CH3COONa和NaSCN混合溶液中,下列排序正确的是( )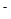 )>c(CH3COOH)>c(HSCN)>c(H
)>c(CH3COOH)>c(HSCN)>c(H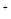 )
)