题目内容
将4 mol A气体和2 mol B气体在A.①③ B.①④ C.②③ D.③④?
解析:从题干可知反应时间及物质C的浓度变化,容易求得v(C)=0.3 mol·L-1·s-1,根据化学计量数很容易得到v(A)和v(B),从而判断①正确,②错误;根据化学反应速率的定义可求得反应消耗的A的物质的量n(A)=0.3×2×2=1.2,再结合“转化率”的概念而得到A的转化率=1.2/4=0.3;结合浓度的含义和化学反应速率的含义,由B的起始浓度减去B在这2 s消耗的浓度(0.15×2=0.3 mol·L-1)得到2s时B的浓度(0.7 mol·L-1)。?
答案:B

练习册系列答案
相关题目
 ;经 2 s后测得 C 的物质的量浓度为 0.6 mol·L-1,现有下列几种说法:
;经 2 s后测得 C 的物质的量浓度为 0.6 mol·L-1,现有下列几种说法: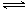 2C(g),若经 2 s(秒)后测得C 的浓度为 0.6 mol·L-1 ,则:①
用物质 A 表示的反应的平均速率
② 2 s 时物质 B 的浓度为
。
2C(g),若经 2 s(秒)后测得C 的浓度为 0.6 mol·L-1 ,则:①
用物质 A 表示的反应的平均速率
② 2 s 时物质 B 的浓度为
。 2C(g)若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法其中不正确的是
2C(g)若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法其中不正确的是  2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列几种说法正确的是
2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列几种说法正确的是