题目内容
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)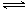 2C(g),若经 2 s(秒)后测得C 的浓度为 0.6 mol·L-1 ,则:①
用物质 A 表示的反应的平均速率
② 2 s 时物质 B 的浓度为
。
2C(g),若经 2 s(秒)后测得C 的浓度为 0.6 mol·L-1 ,则:①
用物质 A 表示的反应的平均速率
② 2 s 时物质 B 的浓度为
。
【答案】
①0.3mol·L-1·S-1 ②0.7mol·L-1
【解析】
试题分析:
2A(g)+B(g)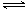 2C(g)
2C(g)
起始浓度(mol/L) 2 1 0
转化浓度(mol/L) 0.6 0.3 0.6
2s时浓度(mol/L) 1.4 0.7 0.6
所以用物质 A 表示的反应的平均速率=0.6mol/L÷2s=0.3mol·L-1·S-1
2 s 时物质 B 的浓度为0.7mol/L
考点:考查反应速率的有关计算
点评:该题时基础性计算题的考查,难度不大。该类试题需要注意的是在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
将 4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol?L-1,
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol?L-1,
现有下列正确的是
| A.用物质 B 表示的反应的平均速率为 0.6 mol?L-1?s-1 |
| B.2 s 时物质 B 的浓度为 0.7 mol?L-1 |
| C.2 s 时物质 A 的转化率为70% |
| D.用物质 A 表示的反应的平均速率为 0.3 mol?L-1?s-1 |
 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,则:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,则: 2C(g),若经2 s后测得C的浓度为0.6 mol/L,现有下列几种说法:
2C(g),若经2 s后测得C的浓度为0.6 mol/L,现有下列几种说法: 2C(气),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法,其中正确的是
2C(气),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法,其中正确的是