题目内容
(10分)(1)一定温度下,在恒容密闭容器中NO2与O2反应如下:4NO2(g)+O2(g) 2N2O5(g);
若已知K350℃< K300℃,则该反应是_______反应(填“吸热”或“放热”)。
反应达平衡后,若再通入一定量NO2,则平衡常数K将______,NO2的转化率 (填“增大”、“减小”或“不变”)
(2)若初始时在恒容密闭容器中加入N2O5,下表为N2O5分解反应在一定温度下不同时间测得N2O5浓度的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
① 写出该反应的平衡常数表达式:K= 。
②1000 s内N2O5的分解速率为 。
③若每有1molN2O5分解,放出或吸收QkJ的热量,写出该分解反应的热化学方程式 。
(10分)(1)放热(1分),不变(1分),变小(1分)
(2)① (2分) ②0.00252 mol·L-1·s-1(2分),
(2分) ②0.00252 mol·L-1·s-1(2分),
③2N2O5(g)=4NO2(g)+O2(g) △H=+2QkJ·mol-1(3分)
解析:

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
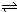 N2O4(g)达到平衡.
N2O4(g)达到平衡.