��Ŀ����
������N2H4��������������һ����Ҫ�Ļ��ȼ�ϣ�N2H4��N2O4��Ӧ�ܷų��������ȣ�
��1����֪��2NO2��g��?N2O4��g����H=-57.20kJ?mol-1��һ���¶��£����ܱ������з�Ӧ2NO2��g��?N2O4��g���ﵽƽ�⣮������������ʱ�����д�ʩ�����NO2ת���ʵ���
A����СNO2��Ũ�� B�������¶� C������NO2��Ũ�� D�������¶�
��2��25��ʱ��1.00gN2H4��l��������N2O4��l����ȫ��Ӧ����N2��g����H2O��l�����ų�19.14kJ����������Ӧ2N2H4��l��+N2O4��l��=3N2��g��+4H2O��l���ġ�H=
��3��17�桢1.01��105Pa��10L�ܱ�������N2O4��NO2�Ļ������ﵽƽ��ʱ��n��NO2��=0.300mol��n��N2O4��=0.120mol������������·�Ӧ2NO2��g��?N2O4��g����ƽ�ⳣ��K����Ҫ��д��������̣���ע��K�ĵ�λ��
��1����֪��2NO2��g��?N2O4��g����H=-57.20kJ?mol-1��һ���¶��£����ܱ������з�Ӧ2NO2��g��?N2O4��g���ﵽƽ�⣮������������ʱ�����д�ʩ�����NO2ת���ʵ���
BC
BC
������ĸ��ţ�A����СNO2��Ũ�� B�������¶� C������NO2��Ũ�� D�������¶�
��2��25��ʱ��1.00gN2H4��l��������N2O4��l����ȫ��Ӧ����N2��g����H2O��l�����ų�19.14kJ����������Ӧ2N2H4��l��+N2O4��l��=3N2��g��+4H2O��l���ġ�H=
-1224.96
-1224.96
kJ?mol-1��3��17�桢1.01��105Pa��10L�ܱ�������N2O4��NO2�Ļ������ﵽƽ��ʱ��n��NO2��=0.300mol��n��N2O4��=0.120mol������������·�Ӧ2NO2��g��?N2O4��g����ƽ�ⳣ��K����Ҫ��д��������̣���ע��K�ĵ�λ��
��������1����ʹ��ѧƽ�������ƶ������ؿ���ʹ����������ת������ߣ�
��2�������Ȼ�ѧ����ʽ�ĺ������ش�
��3������ƽ�ⳣ������ʽ�����㻯ѧ��Ӧ��ƽ�ⳣ����
��2�������Ȼ�ѧ����ʽ�ĺ������ش�
��3������ƽ�ⳣ������ʽ�����㻯ѧ��Ӧ��ƽ�ⳣ����
����⣺��1��A����СNO2��Ũ�ȣ���ʹ��ѧƽ�������ƶ�������������ת���ʽ��ͣ���A����
B�������¶ȣ���ʹ��ѧƽ�������ƶ�������������ת�������ߣ���B��ȷ��
C������NO2��Ũ�ȣ���ϵѹǿ����ƽ�������ƶ�������������ת�������ߣ���C��ȷ��
D�������¶ȣ���ʹ��ѧƽ�������ƶ�������������ת���ʽ��ͣ���D����
��ѡBC��
��2��1.00gN2H4��l��������N2O4��l����ȫ��Ӧ����N2��g����H2O��l�����ų�19.14kJ����������2mol��64gN2H4��l��������N2O4��l����ȫ��Ӧ����N2��g����H2O��l�����ų�19.14kJ��64=1224.96KJ���������ʴ�Ϊ��-1224.96��
��3����������֪ƽ��ʱ��c(N2O4)=0.0120mol?L-1�� c(NO2)=0.0300mol?L-1
K=
=
=13.3��L/mol����
�𣺸������·�Ӧ2NO2��g��?N2O4��g����ƽ�ⳣ��Ϊ13.3��L/mol����
B�������¶ȣ���ʹ��ѧƽ�������ƶ�������������ת�������ߣ���B��ȷ��
C������NO2��Ũ�ȣ���ϵѹǿ����ƽ�������ƶ�������������ת�������ߣ���C��ȷ��
D�������¶ȣ���ʹ��ѧƽ�������ƶ�������������ת���ʽ��ͣ���D����
��ѡBC��
��2��1.00gN2H4��l��������N2O4��l����ȫ��Ӧ����N2��g����H2O��l�����ų�19.14kJ����������2mol��64gN2H4��l��������N2O4��l����ȫ��Ӧ����N2��g����H2O��l�����ų�19.14kJ��64=1224.96KJ���������ʴ�Ϊ��-1224.96��
��3����������֪ƽ��ʱ��c(N2O4)=0.0120mol?L-1�� c(NO2)=0.0300mol?L-1
K=
| c(N2O4) |
| c2(NO2) |
| 0.0120 |
| 0.0300��0.0300 |
�𣺸������·�Ӧ2NO2��g��?N2O4��g����ƽ�ⳣ��Ϊ13.3��L/mol����
���������⿼��ѧ����ѧƽ���ƶ�ԭ���Լ�ƽ�ⳣ���ļ���֪ʶ�����Ը�����ѧ֪ʶ���лش��ѶȲ���

��ϰ��ϵ�д�
�����Ŀ
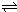 N2O4��g���ﵽƽ�⣮
N2O4��g���ﵽƽ�⣮