题目内容
【题目】沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。已知25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
(1)将浓度均为0.1 mol·L-1的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c(Ba2+)=_____mol·L-1。
(2)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强( pH约为1), 但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是_______________________。(用沉淀溶解平衡原理解释)。万一误服了少量BaCO3,应尽快用大量0.5mol·L-1Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________mol·L-1。
【答案】1×10-5 对于溶解平衡BaSO4(s) ![]() Ba2+(aq)+SO
Ba2+(aq)+SO![]() (aq),H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动 2×10-10
(aq),H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动 2×10-10
【解析】
(1)根据Ksp(BaSO4)=1×10-10计算;
(2)从影响难溶电解质的溶解平衡的角度分析,结合溶度积计算解答。
(1)将浓度均为0.1mol/L的BaCl2溶液与Na2SO4溶液等体积混合,生成硫酸钡沉淀,充分搅拌后过滤,滤液为硫酸钡饱和溶液,c(Ba2+)=c(SO42-),则c(Ba2+)=![]() =
=![]() =1×10-5mol/L,故答案为:1×10-5;
=1×10-5mol/L,故答案为:1×10-5;
(2)由平衡BaSO4(s)![]() Ba2+(aq)+SO42-(aq)可知,H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动;c(SO42-)=0.5mol/L,则由c(Ba2+)×c(SO42-)=1×10-10,可知c(Ba2+)=
Ba2+(aq)+SO42-(aq)可知,H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动;c(SO42-)=0.5mol/L,则由c(Ba2+)×c(SO42-)=1×10-10,可知c(Ba2+)=![]() mol/L =2×10-10mol/L,故答案为:对于溶解平衡BaSO4(s)
mol/L =2×10-10mol/L,故答案为:对于溶解平衡BaSO4(s)![]() Ba2+(aq)+SO42-(aq),H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动;2×10-10。
Ba2+(aq)+SO42-(aq),H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动;2×10-10。

 阅读快车系列答案
阅读快车系列答案【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化变成绿色;见光分解变成褐色。如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl)生产CuCl的流程:
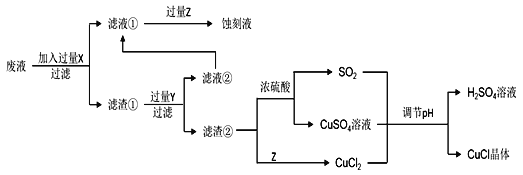
根据以上信息回答下列问题:
(1)生产过程中X的化学式为____。
(2)写出产生CuCl的离子方程式:____。
(3)实验探究pH对CuCl产率的影响如表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为____,当pH较大时CuCl产率变低原因是____。调节pH时,___(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由是____。
(4)氯化亚铜的定量
①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解。
②用0.10mol·L1硫酸铈标准溶液滴定。已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。三次平行实验结果如表(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为_____。(结果保留三位有效数字)。
(5)由CuCl水解再热分解可得到纳米Cu2O。第一步CuCl水解的离子方程式为:CuCl(s)+H2O(l)![]() CuOH(s)+Cl (aq)+H+(aq),第二步CuOH热分解的化学方程式为____。第一步CuCl水解反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____。
CuOH(s)+Cl (aq)+H+(aq),第二步CuOH热分解的化学方程式为____。第一步CuCl水解反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____。
【题目】某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/mol.L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH值 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+1/2O2(g)=H2O(g) ![]() H= -241.8KJ/mol
H= -241.8KJ/mol
C(s)+1/2O2(g)=CO(g) ![]() H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式 ;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 ;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g)
2NO(g) ![]() H>0
H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8×10-4mol.计算该温度下的平衡常数K= ___________;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的![]() H>0,简述该设想能否实现的依据 。
H>0,简述该设想能否实现的依据 。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
【题目】向物质X中逐渐加入(或通入)Y溶液,生成沉淀的量与加入Y的物质的量关系如图所示,下表中符合图示情况的是
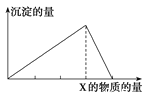
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D


