题目内容
【题目】元素X的原子有3个电子层,最外层有4个电子。则元素X位于周期表的( )
A. 第四周期ⅢA族 B. 第四周期ⅢB族
C. 第三周期IV B族 D. 第三周期ⅣA族
【答案】D
【解析】元素X的原子有3个电子层,最外层有4个电子,则元素X的原子序数是2+8+4=14,即X是Si,位于周期表的第三周期ⅣA族,答案选D。

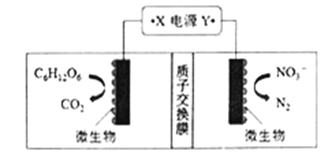
【题目】(1)世界水产养殖协会介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。请写出阴极的电极反应式 _________________________。
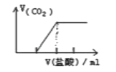
(2)甲醇可利用水煤气合成:CO(g)+2H2(g) ![]() CH3OH(g) △H<0. 一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后CH3OH的体积分数 φCH3OH)变化趋势如图所示。下列说法正确的是___________。
CH3OH(g) △H<0. 一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后CH3OH的体积分数 φCH3OH)变化趋势如图所示。下列说法正确的是___________。
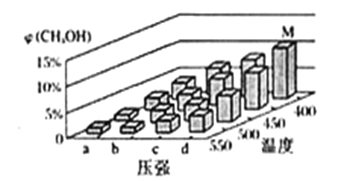
A.状态M,平衡时的CO转化率为10%
B.图中压强的大小关系是a<b<c<d
C.恒温恒压时,在原平衡体系中再充入适量甲醇,重新平衡后体系中甲醇的体积分数不变
D.当体系中 n(CO)/n(H2)的值不随时间变化时,体系达到平衡
(3)二氧化硫和碘水会发生如下二步反应:
反应 | 活化能 | |
第一步 | SO2+I2+2H2O | 9.2kJ·mo1-1 |
第二步 | I2+ I— | 23.5kJ·mo1-1 |
一定条件下,1mol SO2分别加入到体积相同、浓度不同的碘水中,体系达到平衡后,H+、I3—、SO42—的物质的量随n(I2)/n(SO2)的变化曲线如图 (忽略反应前后的体积变化)。

①有人认为X点的I—浓度小于Y点,你认为该观点是否正确________,原因是_________________。
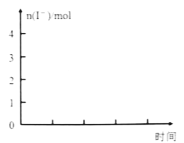
②当n(I2)/n(SO2)=4时,请在下图画出体系中n (I—)反应时间的变化曲线。________
③化学兴趣小组拟采用下述方法来测定I2+I—![]() I3—的平衡常数(室温条件下进行,实验中溶液体积变化忽略不计):
I3—的平衡常数(室温条件下进行,实验中溶液体积变化忽略不计):
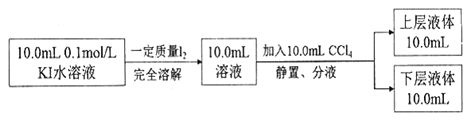
已知:I—和I3 —不溶于CCl4;:一定温度下,碘单质在四氯化碳和水混合液体中,碘单质的浓度比值 ![]() 即是一个常数(用Kd表示,称为分配系数),室温条件下 Kd=85。实验测得上层溶液中c(I3 —)=0.049mol/L,下层液体中c(I2)=0.085mol·L-1。结合上述数据,计算室温条件下I2+ I—
即是一个常数(用Kd表示,称为分配系数),室温条件下 Kd=85。实验测得上层溶液中c(I3 —)=0.049mol/L,下层液体中c(I2)=0.085mol·L-1。结合上述数据,计算室温条件下I2+ I—![]() I3—的平衡常数K=_______(保留三位有效数字)。
I3—的平衡常数K=_______(保留三位有效数字)。