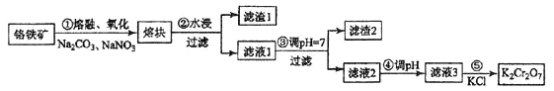
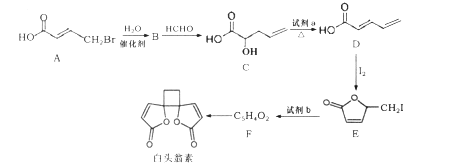
��Ŀ����
����Ŀ��ʳ���еĿ�����������軯�أ��仯ѧʽΪK4[Fe(CN)6]��3H2O���Իش��������⣺
(1)��������֪����Ȼ�����軯���������Ժܵͣ�����ˮ��Һ���ᷴӦ�ų��������軯��(HCN)���壻�����軯�ؼ�����һ���¶�ʱ�ֽܷ�����軯��(KCN)���ݴ��жϣ����ʳƷʱӦע�������Ϊ______________��
(2)��25 ��ʱ����a mol��L��1��KCN��Һ��0.01 mol��L��1������������ϣ���Ӧ�ﵽƽ��ʱ�������ҺpH��7����KCN��Һ�����ʵ���Ũ��a________0.01 mol��L��1(������������������������)���ú�a�Ĵ���ʽ��ʾHCN�ĵ��볣��Ka��____________��
(3)��Fe2����Fe3���Ĵ������£���ʵ��2SO2��O2��2H2O=2H2SO4��ת������֪����SO2�ķ���ͨ�뺬Fe2����Fe3������Һ��ʱ������һ����Ӧ�����ӷ���ʽΪ4Fe2����O2��4H��=4Fe3����2H2O������һ����Ӧ�����ӷ���ʽΪ____________������ת������Ҫ��������______________��
(4)��֪Fe(OH)3���ܶȻ�����Ksp��1.1��10��36������ʱ��FeCl3��Һ�еμ�NaOH��Һ������ҺpHΪ3ʱ��ͨ������˵��Fe3���Ƿ������ȫ________ (��ʾ����ij����Ũ��С��10��5 mol��L��1ʱ������Ϊ�����ӳ�����ȫ)
���𰸡����������������һ�������������¶Ȳ�Ҫ̫�� �� ��100a-1����10-7 molL-1 2Fe3����SO2��2H2O=2Fe2����SO42-��4H�� ���Ϊ����������Ⱦ c(Fe3��)��![]() ��1.1��10��3 mol��L��1��1��10��5 mol��L��1����Fe3��û�г�����ȫ
��1.1��10��3 mol��L��1��1��10��5 mol��L��1����Fe3��û�г�����ȫ
��������
(1)���ᷴӦ�ų��������軯��(HCN)���壬�����軯�ؼ�����һ���¶�ʱ�ֽܷ�����軯��(KCN)��
(2)���ǵ�Ũ�ȣ���Ӧ������HCN����Һ��ʾ���ԣ��ٸ��ݵ��볣����ʽ���HCN�ĵ��볣����
(3)�������ص㣬�ָ�ԭ��״̬��Fe3+��Fe2+�����Խ���SO2����Ⱦ��ͬʱ�Ƶ����
(4)��Һ��c(H+)=10-3mol/L����c(OH-)=10-11mol/L ������Ksp=1.1��10-36=[c(OH-)]3��c(Fe3+)���㡣
(1)���������ᷴӦ�ų��������軯��(HCN)���������ٽ�ϼ�����һ���¶�ʱ�ֽܷ�����軯�أ���Ӧ������ס�����������������һ�������������¶Ȳ�Ҫ���ߣ�
(2)KCN+HCl�TKCl+HCN�����ǵ�Ũ�ȣ�����HCNӦ�ó����ԣ�����Ӧ��PH=7�����ԣ�˵��KCN��ʣ��(KCNˮ��ʼ���)������a��0.01mol/L��HCN![]() H++CN-��Ka=
H++CN-��Ka= ����Һ��������c(H+)=10-7mol/L��c(CN-)=
����Һ��������c(H+)=10-7mol/L��c(CN-)=![]() mol/L(�������ϣ�ԭŨ�ȶ�����)c(HCN)=
mol/L(�������ϣ�ԭŨ�ȶ�����)c(HCN)=![]() mol/L�����빫ʽ��Ka=
mol/L�����빫ʽ��Ka=![]() =
=![]() =(100a-1)��10-7 molL-1��
=(100a-1)��10-7 molL-1��
(3)���ݴ������ص㣬��һ����Ӧһ����Fe3+��Fe2+����Ӧ����ʽΪ 2Fe3++SO2+2H2 �T2Fe2++SO42-+4H+��ͨ����Ӧ�������˴�����Ⱦ��SO2��ͬʱ�Ƶ������
(4)��ҺpHΪ3ʱ����Һ��c(H+)=10-3 mol/L����c(OH-)=10-11 mol/L ��Ksp=1.1��10-36=[c(OH-)]3��c(Fe3+)��c(Fe3+)=![]() =1.1��10-3(mol/L)��10-5 molL-1����Fe3��û�г�����ȫ��
=1.1��10-3(mol/L)��10-5 molL-1����Fe3��û�г�����ȫ��

 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д� ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д�����Ŀ�������£���һԪ��HA����Һ��KOH��Һ�������ϣ���������仯����ʵ���������±��������ж���ȷ���ǣ�������
ʵ���� | ��ʼŨ��/��mol��L��1�� | ��Ӧ����Һ��pH | |
c��HA�� | c(KOH) | ||
�� | 0.1 | 0.1 | 9 |
�� | x | 0.2 | 7 |
A.ʵ��ٷ�Ӧ�����Һ�У�c��A������c��K+����c��OH������c��H+��
B.ʵ��ٷ�Ӧ�����Һ�У�c��OH����=c��K+����c��A����=![]() mol/L
mol/L
C.ʵ��ڷ�Ӧ�����Һ�У�c��A����+c��HA����0.1 mol/L
D.ʵ��ڷ�Ӧ�����Һ�У�c��K+��+c��OH����=c��H+��+c��A����